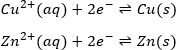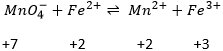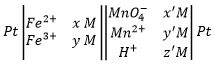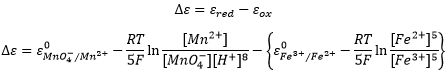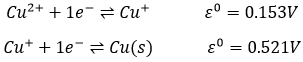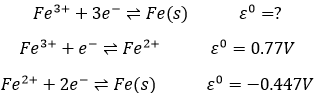Oxydo-réductions, ou redox, sont des réactions impliquant un transfert de charge entre les molécules. Au cours de ces réactions de l’énergie chimique est transformée en énergie électrique.
Une réaction d’oxydation est une réaction au cours de laquelle un substrat (molécule, atome ou ion) perd des électrons.
Une réaction de réduction est une réaction au cours de laquelle un substrat gagne des électrons.
Un oxydant est un substrat ayant la capacité d’oxyder d’autres substances. Pendant ce processus l’agent d’oxydation est ainsi réduit. Il est aussi appelé oxydant ou agent oxydant.
Un agent réducteur est un substrat ayant la capacité de réduire d’autres substances. Pendant ce processus l’agent réducteur est ainsi oxydé. Il est aussi appelé réducteur ou agent réducteur.
L’état d’oxydation :
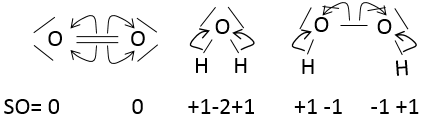
L’état d’oxydation (EO) est un nombre entier dont la valeur est la charge d’un atome si nous brisons toutes ses liaisons. Dans O2, chaque atome reprend ses électrons (c’est un clivage homolytique ou homolyse). La charge globale de O2 est neutre. Ainsi l’ EO de chaque oxygène est égal à 0. Cependant, dans H2O, l’oxygène prend les électrons provenant de l’hydrogène lorsque nous brisons les liaisons parce que l’oxygène est plus électronégatif que l’hydrogène (c’est un clivage hétérolytique ou hétérolyse). L’ EO de l’oxygène dans H2O est -2 et l’ EO de l’hydrogène est de +1 :
En général le SO de l’oxygène est de -2 et nous pouvons trouver le SO des autres atomes de la molécule sans représentation complète de la molécule. Par exemple, nous pouvons déterminer l’état d’oxydation du manganèse dans MnO4– : la charge globale est -1 et chaque oxygène a un SO de -2. Le SO de Mn est donc 7 de sorte que la charge globale est égale à la somme des états d’oxydation -1 = + 7- (4x-2). Dans l’eau lourde, H2O2, le SO de l’oxygène est -1.
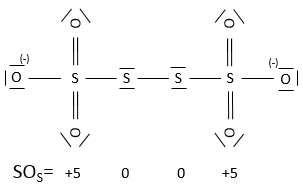
Un atome peut donc avoir plusieurs SO possibles. Si plusieurs SO sont présents pour un atome dans une seule molécule nous prenons la moyenne entre eux. Par exemple S a un SO de 2,5 dans S4O62-. Le soufre peut avoir un SO de 0 (soufre solide) à +6 (H2SO4) :
Les réactions d’oxydoréduction :
Ainsi, dans une réaction d’oxydo-réduction, un oxydant oxyde un agent réducteur tandis que le réducteur réduit l’oxydant. En présence de deux composés il n’est cependant pas toujours évident de déterminer la direction de la réaction :
Cette réaction implique deux demi-réactions :
La réaction ira dans le sens qui a une enthalpie négative. Dans le cas présent, la réaction va de gauche à droite et peut être expliquée parce que le Cu est plus électronégatif que le Zn. Il est donc plus difficile de prendre les électron du Cu que du Zn.
Il est possible de déterminer la force des agents oxydants et réducteurs à partir de leur aptitude à attirer les électrons dans une batterie, à savoir leur potentiel standard ε0 (en volts). Cependant, la valeur absolue du potentiel standard n’est pas mesurée. Nous ne pouvons connaître la valeur de ε0 en ce qui concerne un autre couple. Nous utilisons le couple H+/H2 comme une référence, avec son ensemble potentiel standard ε0=0.000V, dans sctp par convention. Le nom d’un couple est mis dans le sens de la réduction : oxydant/réducteur par exemple : Cu2+/Cu, Zn2+/Zn.
Pour établir correctement une réaction d’oxydo-réduction, un procédé existe :
Premièrement, nous écrivons l’équation supposée sans stoechiométrie, protons, de l’eau ou OH–. Juste les oxydants et les réducteurs. Nous déterminons leur état d’oxydation
Deuxièmement, nous déterminons les potentiels standards individuels de chaque couple. Les valeurs de ε0 peuvent être trouvées pour une large gamme de composés sur le dos du tableau de Mendeleïev. Elles sont données pour les réactions de réduction (pour l’oxydation il faut prendre la valeur négative). Pour le fer, l’éqiuation de la réaction est :
Pour le manganèse 5 électrons sont ajoutés pour obtenir Mn2+
Soyez attentifs pour calculer le nombre d’atomes qui sont réduits/oxydés. Dans le couple Cr2O72-/Cr3+, le Cr a un SO de + 6 → + 3 par conséquent 6 électrons doivent être ajoutés dans la réaction parce que deux Cr sont réduits.
Pour en revenir au problème impliquant le manganèse la réaction n’est pas encore bien équilibrée. L’oxygène est également impliqué dans le processus. Nous équilibrons la réaction avec les molécules d’eau, des protons ou des OH– en fonction de l’acidité de la solution. Pour déterminer combien d’espèces sont nécessaires, nous comptons les charges de chaque côté de la flèche :
Il ya 6 à gauche parce MnO4-est chargé négativement. La différence de huit charges est compensée par l’addition de 8 protons à gauche de la flèche et on équilibre l’équation :
Le potentiel standard de cette réaction est connu. Maintenant nous mettons ensemble les deux demi-réactions. Ne pas oublier de considérer qu’une demi-réaction introduit 5 électrons et l’autre introduit un électron. L’équation de Fe3+/Fe2+ est donc multipliée par 5 :
Cette réaction finale est correctement équilibrée. A noter que même si la demi-réaction Fe3+/Fe2+ est multipliée par 5 elle ne se multiplie pas dans la détermination du potentiel standard. Comme Δε0>0 cela signifie que la réaction va aller de gauche à droite. Cette réaction est spontanée si la production d’enthalpie ΔG0<0. L’enthalpie de réaction est une mesure du travail nécessaire pour faire la réaction. Si cette valeur est négative la réaction est spontanée et libère de l’énergie, généralement sous forme de chaleur. La réaction est alors exothermique. Si cette valeur est positive il est nécessaire de donner un peu d’énergie pour faire la réaction. La réaction est endothermique car il absorbe la chaleur de son environnant.
La relation entre l’enthalpie de la réaction et son potentiel est :
Cette relation vient du fait qu’un potentiel V est la variation de travail J pour modifier la charge Q
Batteries :
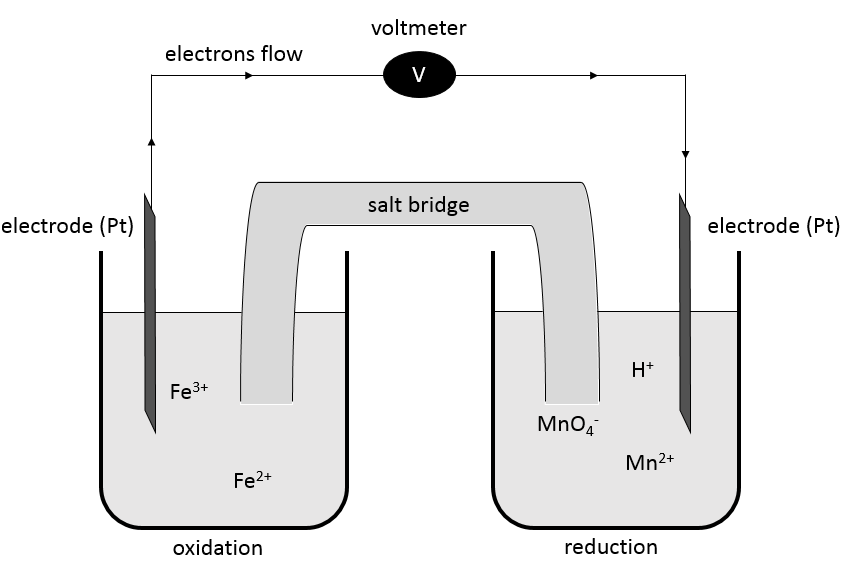
Dans les batteries les éléments d’une réaction redox sont séparés. Les deux solutions sont reliées par un pont de sel et deux électrodes reliées à un voltmètre :
Un pont de sel est un dispositif utilisé pour connecter deux demi-batteries qui sont pleines d’espèces ioniques conductrices de l’électricité (électrolytes) mais sans interférence avec les composés de la batterie. Sans le pont de sel une demi-cellule aurait accumulé des charges négatives et l’autre demi-cellule aurait accumulé des charges positives durant la réaction. Les cations et anions du demi-pont sont choisis de telle sorte qu’ils aient une haute conductivité similaire. KCl, KNO3, NH4Cl sont quelques exemples d’électrolytes qui composent un pont de sel.
Une batterie est écrite, par convention, comme suit :
Les électrodes sont placées aux extrémités et les composés de deux demi- batteries sont séparés par une double ligne symbolisant le pont de sel. L’oxydation est mise en premier et la réduction en second.
L’oxydation de Fe2+ est effectuée à l’électrode de platine qui attire l’électron libéré. Cet électron passe par le voltmètre à l’autre demi-batterie où il est utilisé dans la réduction. Le pont de sel ferme le circuit électrique.
Le potentiel d’une batterie, également appelée force électromotrice, est donné par l’équation Nernst et dépend de la concentration des différentes espèces :
On peut également obtenir le potentiel à partir de la différence entre les deux cellules de la batterie :
Veillez à ce que les concentrations de Fe2+ et Fe3+ soient inversées dans la dernière équation parce que nous considérons les produits et réactifs de demi-batterie dans ce cas.
Dans une pile de concentration la force électromotrice est seulement donnée par les concentrations des espèces :
Les deux côtés de la batterie ont le même ε0 et l’équation de la force électromotrice est donc limité à :
Ici nous ne pouvons pas utiliser KCl comme électrolyte parce que Cl- réagirait avec Ag + pour former un précipité d’AgCl.
Électrodes de référence :
Une électrode de référence est une électrode dont le potentiel est connu et ne varie pas pendant une expérience. L’électrode d’hydrogène standard (SHE) est une première électrode de référence mais n’est pas souvent utilisé car il n’est pas entièrement reproductible :
Le gaz de dihydrogène est introduit dans une solution acide de 1M avec une pression de 1 atm.
L’électrode en chlorure d’argent est utilisé comme électrode de référence :
Le potentiel de l’électrode dépend de la concentration de la forme ionique de Ag.
Cependant, cette concentration dépend aussi de la solubilité dans l’eau de AgCl.
La constante de dissolution de AgCl est KS =[Ag+][Cl–]. En saturant la solution avec du KCl (> 3,6) la concentration de chlorure reste constante d’où la concentration fixe de Ag +.
Le potentiel écrit ci-dessus n’est pas tout à fait exact car, à de fortes concentrations, la concentration n’est plus égale à l’activité d’un ion.
L’électrode au calomel saturé utilise le même principe :
Ici les cations précipitent avec du chlorure de mercure qui est saturé de la même manière que pour l’électrode de chlorure d’argent :
L’inverse de la batterie est une électrolyse : un courant est appliqué à une cellule pour induire une réaction avec une force électromotrice négative. C’est un moyen de déposer des métaux à partir d’une solution :
La quantité de métal déposé est fonction du courant appliqué :
Tous les éléments de la première colonne du tableau de Mendeleïev sont obtenus par électrolyse. Dans la nature ils existent dans leur forme oxydée parce que le monde est oxydant : H2O et O2 sont partout. La production de Na peut être faite à partir de son sel par électrolyse :
Cette réaction est réalisée à haute température (> 600° C) et en absence totale d’eau.
Dismutation :
Dans certains cas une seule espèce joue simultanément le rôle d’oxydant et de réducteur. Une réaction impliquant un tel processus est appelée dismutation. Le sel de cuivre se dissocie dans l’eau en Cu + et Cl-. Cependant le cuivre solide est obtenu au cours du processus, il est une conséquence de la dismutation du cuivre :
Comme la deuxième réaction a un plus grand potentiel la réaction globale forme du cuivre massif :
Le Cu+ dissocié du CuCl forme spontanément Cu2+ et Cu (s).
Le monoxyde de carbone est le résultat de dismutation entre le CO2 et C. C’est souvent responsable de nombreux incidents, parfois mortels, dans une salle de bains avec une ventilation insuffisante. Des traces de carbone obtenues à partir de composés organiques brûlés, réagissent avec le dioxyde de carbone émis par les chaudières ou les appareils de chauffage. Le problème est que le CO prend la place de O2 sur nos cellules sanguines (hémoglobine) et est plus fortement lié à elles que O2 (par un facteur 200). Une fois que le CO est lié à une cellule sanguine, O2 peut avoir beaucoup de difficulté à se lier, par conséquent, à une petite proportion de CO peut être catastrophique. Pour traiter les personnes touchées par le CO, elles sont placées dans une chambre avec une surpression en O2 pour forcer l’équilibre et enlever le monoxyde de carbone.
Le potentiel standard d’une réaction peut être trouvé à partir de ses réactions intermédiaires :
Au total 3 électrons sont nécessaires pour obtenir le fer dans son état solide. Un électron est nécessaire pour la première étape et 2 pour la seconde étape. Le potentiel standard (approximatif) est trouvé par une combinaison du potentiel standard de chaque étape, en prenant, en compte les électrons nécessaires pour chaque étape:
- Au total, le processus a un potentiel standard négatif. La réaction inverse est ainsi spontanée en présence d’un oxydant.C’est la production de stain (Fe3+ hydraté) de fer. Sur une voiture par exemple le fer est protégé par une mince couche de peinture/revêtement, ne permettant pas à l’eau d’aller au contact du fer. Si il y a un défaut sur le revêtement, le fer va être oxydé, mais la tache ne va pas apparaître toujours à cet endroit : les électrons libérés par l’oxydation peuvent se déplacer à travers le métal.
Pour éviter cela les surfaces sont reliées, par un câble électrique, à une pièce de zinc. Le zinc va s’oxyder à la place du fer parce que son potentiel standard est plus petit.
Stain est un matériau poreux et l’oxygène peut le traverser pour aller plus loin. ZnO n’est pas poreux donc une monocouche de Zn peut protéger les pièces de fer de tache. C’est le principe de l’acier inoxydable, mais appliqué avec Cr2O3.