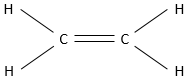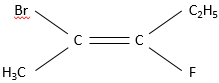Les alcènes:
Les alcènes sont des composés organiques à base de carbone et des atomes d’hydrogène. Contrairement aux alcanes, qui ont les mêmes composants, la formule générale des alcènes n’est pas CnH2n + 2. Dans un alcène, deux atomes de carbone sont liés par une liaison pi (également appelé double liaison). Le plus petit alcène est l’éthylène CH2 = CH2.
Pour former cette liaison, chaque carbone partage deux électrons, une pour la liaison sigma et une pour la liaison pi. Il ya donc 2 hydrogènes en moins sur un alcène (que sur un alcane) dans lequel une seule liaison pi est présente. La formule générale est donc CnH2n pour un monoalcène et le nombre d’hydrogène est réduite de deux pour chaque liaison pi supplémentaire.
propène est CH2 = CH-CH3 et CH2 = C = CH2 est l’ allène.
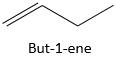
Pour des molécules plus grandes, la position de l’alcène doit être signifiée dans la formule. L’alcène est lié à deux atomes de carbone de la chaîne et qui est toujours dans la chaîne principale, même si une chaîne plus longue peut être trouvée.
Par exemple :
est le but-1-ène. La nomenclature : le suffixe -ane des alcanes est éliminé et est remplacé par le suffixe-ène, elle-même précédée par la position de l’atome de carbone portant le groupe fonctionnel.
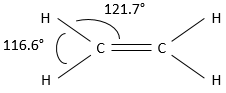
Un carbone partageant une double liaison est lié à trois autres atomes, et pas 4. En conséquence, la structure tétraédrique du carbone n’est plus la structure la plus stable à adopter dans le cas d’alcènes. Pour avoir une distance optimale entre les atomes, les trois liaisons sont dans le même plan. L’angle entre les liaisons est proche de 120°. La double liaison prend juste un peu plus d’espace que les liaisons simples.
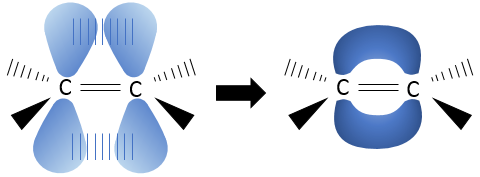
La liaison pi est moins énergique que la liaison sigma, mais elle est assez forte pour interdire la rotation d’atomes d’hydrogène autour de l’axe C = C. La liaison pi est une liaison entre les électrons sp2. Ces électrons sont situés perpendiculairement au plan de la molécule.
Pour former la liaison pi les orbitales électroniques sp2 doivent être alignées. Sinon les orbitales ne pourraient pas se superposer ensemble et seraient trop éloignées pour former la liaison pi, la rotation n’ est donc plus possible.
Cela signifie également que les atomes (chaînes) reliées à la double liaison restent dans une position fixe les uns par rapport aux autres autres et que nous pouvons nommer spécifiquement les composés en fonction de leur connectivité.
Prenons un exemple pour expliquer comment nommer les alcènes avec des substituants sur la double liaison.
Cette alcène porte un brome, un fluor et le reste de la chaîne carbonée. Pour nommer cette substance nous regardons les atomes directement liés aux atomes de carbone portant la liaison pi. Une priorité est donnée pour chacun des deux atomes de carbone, elle va à l’atome avec le poids atomique le plus grand, dans ce cas, Br> F> C. Concernant la priorité entre les atomes de carbone, nous regardons les atomes qu’ils portent et, encore une fois, la priorité va au carbone portant l’atome de poids atomique le plus grand. La priorité est donc Br> F> C2H5> CH3.
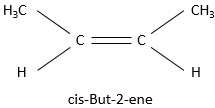
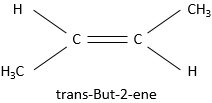
Les substituants sont en position cis lorsque ceux-ci tout en ayant la priorité supérieure, sont situés du même côté de la liaison pi, sinon la position est trans.
Cette alcène par exemple
est appelée cis-but-2-ène tandis que le trans-but-2-ène est cette molécule
Cependant cette méthode est limitée et une méthode plus générale doit être utilisée dans le cas de molécules plus complexes comme notre exemple, nous utilisons le E, Z système. La priorité sur le carbone est laissé Br> CH3. Sur la droite de carbone, F> C2H5. Si les subsituts de priorité plus élevée sont du même côté de la double liaison la molécule a une configuration Z (pour Zusammen, ensemble en allemand). S’ils sont sur les côtés opposés de la configuration alors la configuration est dite E (pour Entgegen, en face en allemand).
La molécule de notre exemple est ainsi nommée (E) -2-bromo-3-Fluoropent-2-ène.
Exercices: nommez les molécules suivantes
cet article a été traduit de l’anglais (cf borzuya university en anglais)