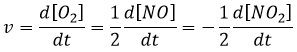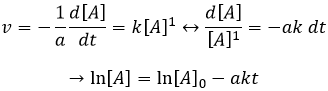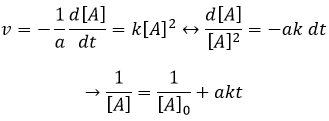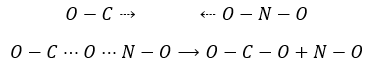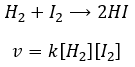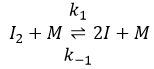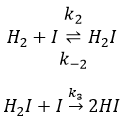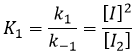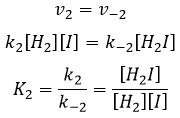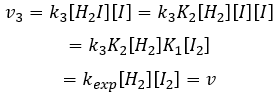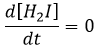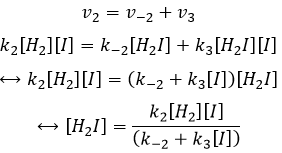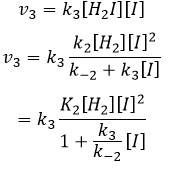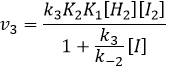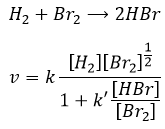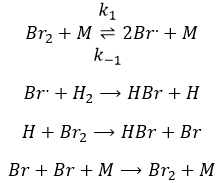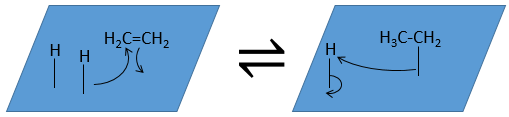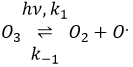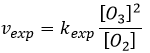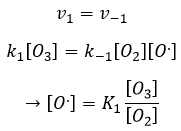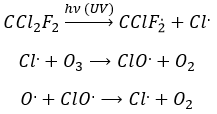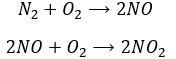Cinétique chimique :
La cinétique est un domaine de la chimie qui étudie la vitesse des réactions. La vitesse de la réaction peut dépendre des conditions de la réaction. Par exemple lorsque nous mettons H2 (g) et O2 (g) nous ne produisons pas de l’eau spontanément :
Cette réaction a une ΔG0 très négative. Cependant si nous produisons une étincelle la réaction va aller très vite.
Nous avons vu que la température a une influence sur l’équilibre des réactions. Au SCTP la formation d’ammoniac a une ΔG0 négative mais devient positive pour des températures de plus de 434 K :
Sans variation de température une réaction peut être accélérée si l’on utilise un catalyseur. Nous allons discuter des catalyseurs plus loin dans ce chapitre.
Il peut donc être important de connaître la vitesse des réactions en fonction de différents paramètres afin d’optimiser la production d’une molécule particulière, la destruction de certains déchets ou tout autre procédé.
La vitesse d’une réaction est une variation de la concentration des espèces engagées dans la réaction en fonction du temps. Elle est toujours positive. Comme il peut y avoir plusieurs différents coefficients stoechiométriques, nous devons nous entendre sur la définition de la vitesse d’une réaction parce que les concentrations ne varient pas de la même façon. Pour obtenir cette vitesse, on divise la variation dans le temps de la concentration des espèces correspondantes par le coefficient stoechiométrique. Dans la réaction :
nous considérons une seule vitesse de réaction qui est :
Les concentrations des réactifs diminuent au fil du temps et le débit est de signe opposé à la variation de leur concentration :
Pendant la réaction la vitesse dépend de la concentration de toutes les espèces impliquées :
Les coefficients α, β et γ sont l’ordre de la réaction en ce qui concerne les espèces correspondantes et leur somme α + β + γ est l’ordre global de la réaction. L’ordre de la réaction à l’égard de l’une des espèces est souvent leur coefficient stoechiométrique mais pas systématiquement.
A l’équilibre la vitesse de la réaction dans une direction est égale à la vitesse de la réaction dans l’autre sens :
Il est faux de dire que v = 0. Les deux réactions ont la même vitesse.
Au début de la réaction on peut négliger les concentrations des produits de l’expression de la vitesse avec β = γ = 0. La vitesse au début de la réaction est donc simplement :
Méthode intégrale :
On peut déterminer l’ordre de la réaction en ce qui concerne une espèce en gardant constante la concentration des autres réactifs. Fondamentalement nous mettons un grand excès de réactifs sauf pour les espèces que nous voulons étudier. De cette façon, seulement, une concentration varie de façon significative. Pendant la réaction on détecte la variation de la concentration de l’espèce cible dans le temps :
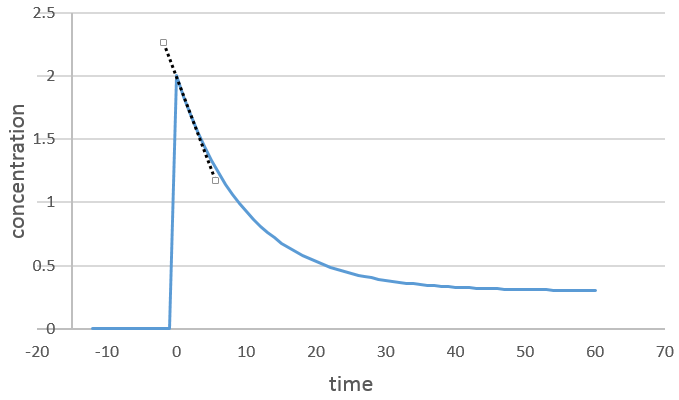
Nous nous concentrons sur la période de temps juste après le début de la réaction. Avant cela il n’y a aucune variation détectable (le réactif n’est probablement même pas dans la solution), puis les produits peuvent jouer un rôle dans la vitesse de réaction.
Si la réaction a un ordre égal à 1 à l’égard des espèces cibles la vitesse est :
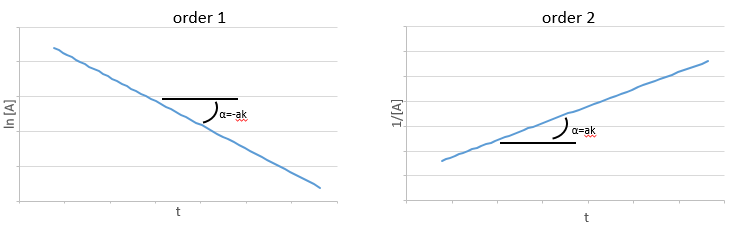
Et ainsi nous pouvons trouver une ligne droite lorsque nous traçons ln [A] en fonction du temps dont la pente est -ak :
Si l’ordre = 2, le ln [A] ne donnera pas une ligne droite mais 1/[A] le fera. Dans ce cas la pente est ak :
L’ordre peut également être égal à zéro ce qui signifie que la concentration du réactif n’a pas d’importance (sauf pour de très faibles concentrations). Cela signifie que la réaction est limitée par quelque chose d’autre. Nous observons souvent un ordre zéro avec les réactions qui se déroulent en présence d’un catalyseur.
Les catalyseurs sont des espèces qui affectent la réaction mais ne sont pas consommés pendant la réaction. Les catalyseurs les plus communs sont solides mais certains catalyseurs sont liquides. Sur les catalyseurs solides les réactifs peuvent se lier. En raison de cette nouvelle liaison, les liaisons dans le réactif sont plus faibles et la réactivité est améliorée. La réaction est ainsi limitée par l’espace disponible sur le catalyseur. La solution est mélangée au cours de la réaction afin qu’il y ait toujours des réactifs au voisinage du catalyseur. Sinon les réactifs seront de plus en plus loin du catalyseur au fur et à mesure que le temps passe. L’évolution de la concentration serait plus complexe dans ce cas. Nous allons discuter à propos des catalyseurs plus tard.
La méthode des vitesses initiales :
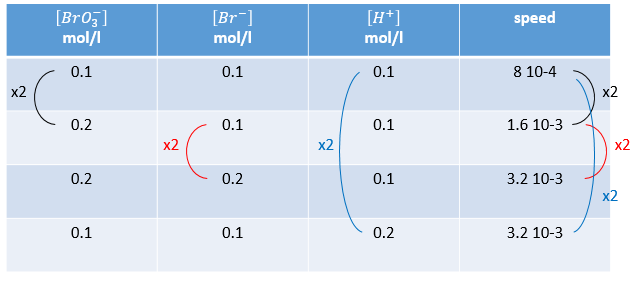
Au lieu d’utiliser des excès de réactifs nous pouvons faire plusieurs expériences et varier la concentration, à chaque fois :
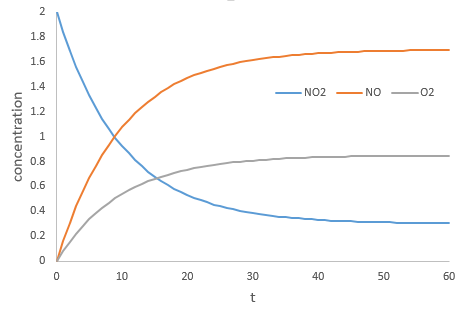
n’est évidemment pas une réaction simple. La vitesse dépend simultanément des trois réactifs BrO3–, Br– et H+. Nous faisons d’abord la réaction avec des concentrations identiques [BrO3–] = [Br–] = [ H+] = 0.1M. Nous analysons l’évolution de la concentration d’une espèce en fonction du temps et on ne considère que la variation de concentration directement après le début de la réaction pour déterminer la vitesse de la réaction :
Dans un second temps nous faisons la même réaction mais modifions la concentration d’un des réactifs. La vitesse de réaction va changer en conséquence et ainsi nous pouvons déterminer l’ordre pour chaque espèce. Finalement lorsque nous savons tous les ordres nous pouvons déterminer la valeur de k.
Modèle de collisions :
Les réactions sont décomposées dans les événements élémentaires. Dans ce cas l’ordre est le coefficient stoechiométrique (généralement 1 ou 2). Les événements élémentaires sont des réactions qui sont effectuées en une seule étape : tout est fait lors de la collision entre les deux molécules :
Par exemple la réaction entre le monoxyde de carbone CO et le NO2 est un événement primaire : l’atome d’oxygène est transféré de NO2 au CO lors d’une collision entre les deux espèces. Lorsque l’impact se produit et les molécules sont dans la bonne orientation la liaison N-O s’affaiblit et simultanément une liaison est formée entre C et O :
Les collisions entre les molécules ne conduisent pas toujours à un nouveau produit et il y a des conditions pour que la réaction se produise. Le produit intermédiaire de réaction OCONO ne peut être obtenu que si la collision vient d’un angle donné : l’intermédiaire est linéaire. En plus de cette limitation spatiale pour transférer l’atome d’oxygène la liaison entre O et N doit être étirée, ce qui nécessite de l’énergie. Enfin il existe une variation du nombre de moles de gaz au cours de cette réaction : NO est un liquide et par conséquent il implique une diminution de l’entropie qui doit être entièrement dégagée.
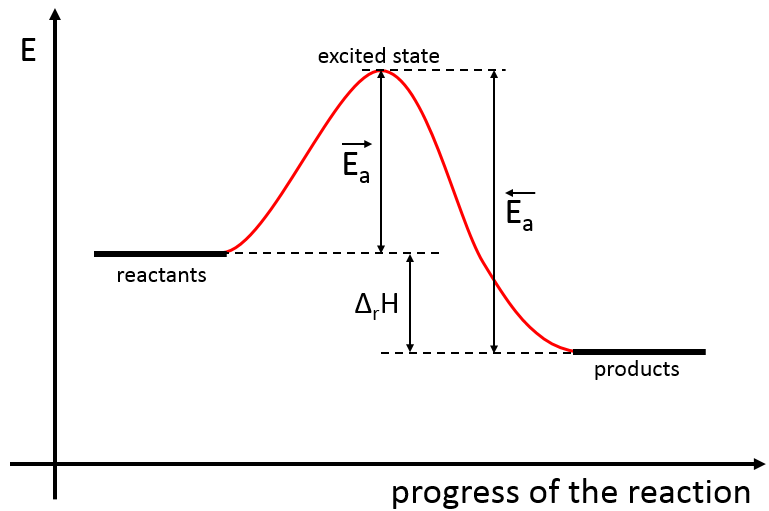
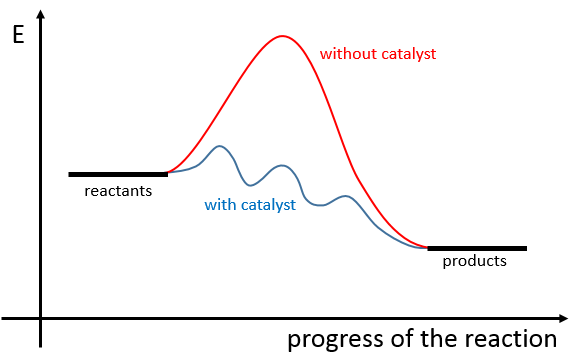
Il existe donc un minimum d’énergie qui est nécessaire pour obtenir la réaction. Cette énergie est appelée l’énergie d’activation. On peut représenter l’évolution d’une réaction par le graphique suivant :
Les réactifs, pris séparément, ont une quantité donnée d’énergie. Les produits de la réaction ont une énergie plus faible. La différence d’énergie entre les produits et les réactifs est l’enthalpie de la réaction. Pour obtenir les produits l’énergie d’activation est similaire à une barrière qui doit être montée. Au sommet de cette barrière se trouve l’état excité, appelé de cette façon parce qu’il est riche en énergie. Après l’état excité l’énergie diminue vers le bas pour atteindre le niveau d’énergie, des produits, qui doit être inférieur à l’énergie des réactifs.
Pour faire la réaction dans l’autre direction, en formant du CO et NO2, l’énergie d’activation est beaucoup plus grande et les produits sont énergétiquement moins favorables. La différence entre les deux énergies d’activation est aussi égale à l’enthalpie de réaction.
Pour dépasser l’énergie d’activation les molécules doivent avoir assez d’énergie cinétique. Si tel est le cas elles auront des collisions avec succès. Rappelez-vous que l’énergie cinétique des molécules dépend de la température. Si la température augmente une plus grande population de molécules aura une énergie cinétique supérieure à l’énergie d’activation.
Dans l’expression de la vitesse de la réaction on trouve ces dépendances dans la constante de vitesse k :
Le paramètre d’énergie se trouve dans l’exponentielle et le paramètre spatial et la fréquence, des collisions, se trouvent dans la constante A.
Notez que les molécules lentes peuvent également réagir si elles ont une grande énergie potentielle par exemple beaucoup d’énergie de vibration. Au lieu de l’énergie cinétique l’énergie potentielle est utilisée :
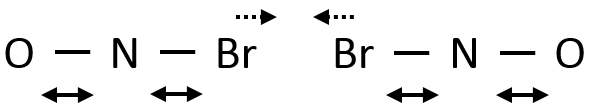
Par conséquent si deux NOBr sont correctement alignés ils peuvent former Br2 même si leur énergie cinétique est faible en raison de la vibration des liaisons Br-N :
Eventuellement les liaisons N-Br peuvent être étirées simultanément, en approchant les deux Br l’une de l’autre on peut faciliter la formation de Br2.
La vitesse de la réaction pour former l’acide iodhydrique à partir d’hydrogène et d’iode peut nous faire penser que c’est une réaction élémentaire :
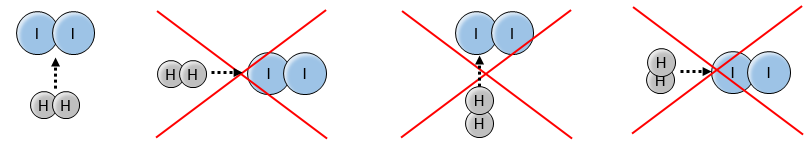
En effet les exposants des concentrations sont les coefficients stoechiométriques des réactifs. Toutefois cette réaction n’est pas une réaction élémentaire. Pour être une réaction élémentaire il faudrait que les molécules soient alignées d’une manière spécifique et que les liaisons se cassent et se forment en même temps. Cela signifie que les quatre événements doivent se produire en même temps, en plus de l’angle de collision spécifique :
Pourtant la réaction se fait à une vitesse telle que nous pouvons penser à un événement élémentaire. Alors que la réaction complète est la succession de plusieurs évènements élémentaires qui se produisent l’un après l’autre.
La première étape est la dissociation homolytique de I2. Cela se fait à l’aide d’un métal catalyseur :
Il a été observé que la composition du récipient peut affecter la vitesse de la réaction. La dissociation se fait donc à la surface du récipient. Après la dissociation I peux réagir avec H2 pour former H2I qui peut réagir avec le second I de la première réaction pour produire 2 HI.
Alors que la dernière réaction est complète, la première et deuxième réaction sont des réactions d’équilibre et peuvent donc aller dans les deux sens.
La vitesse globale de la réaction est déterminé par l’événement primaire le plus lent. Cette étape lente est la dernière réaction :
Comment nous pouvons prouver que cette vitesse est égale à celle obtenue expérimentalement?
Pour obtenir une telle chose, nous utilisons deux hypothèses :
les réactions d’équilibre sont presque à l’équilibre : la troisième réaction est plus lente que les deux premières réactions et on suppose que la différence de vitesse est telle que les premières réactions (presque) ont le temps pour atteindre l’équilibre. Par conséquent, on peut dire que pour ces deux réactions la vitesse dans une direction est égale à la vitesse dans la direction opposé :
Le rapport entre les constantes de réaction k1 / k-1 est la constante K1 global.
Nous pouvons faire la même chose pour la deuxième équation :
Nous pouvons maintenant remplacer les concentrations de v3 avec les expressions que nous avons trouvées tout à l’heure :
La constante qui a été trouvée expérimentalement est donc une combinaison des trois constantes de réaction.
la concentration de H2I est constante :
H2I est le produit de la deuxième réaction et le réactif de la troisième réaction. Par cette hypothèse nous supposons que dès que H2I est produit, il sera consommé par l’étape suivante de la réaction ou redevient H2 et I par l’inverse de la deuxième réaction.
Nous pouvons insérer cela dans l’expression de la v3 :
Étant donné que v1=v-1 (à partir de la première hypothèse), [I]2=K1[I2] et :
Nous avons ici la même expression que celle que nous avons obtenue avec la première hypothèse dans le numérateur. Nous pouvons donc faire l’hypothèse que la concentration de H2I est constante si K3 [I] / k-2 << 1, à savoir que la concentration de I est petite et que k3<<k-2. Elle est donc seulement correcte au début de la réaction.
Nous pourrions penser que l’hydrogénation de Br2 suit la même cinétique, mais nous sommes loin de la vérité. En effet :
Cette réaction est également une série d’étapes élémentaires
Le catalyseur :
Un catalyseur est une espèce qui est impliquée dans une réaction mais non consommée ou produite pendant la réaction. Il permet à la réaction de se produire par une diminution de l’énergie d’activation.
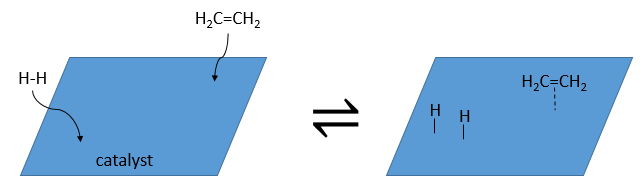
Un catalyseur peut être dans la même phase que les réactifs, dans ce cas on parle d’un catalyseur homogène ou dans une phase différente, comme par la réaction entre H2 et I2 dans lequel le catalyseur est la surface du récipient, un solide. Dans ce cas nous parlons d’un catalyseur hétérogène. Il existe au moins 4 étapes de l’action du catalyseur. Nous allons les voir dans la réaction de l’hydrogénation catalytique de l’éthylène :
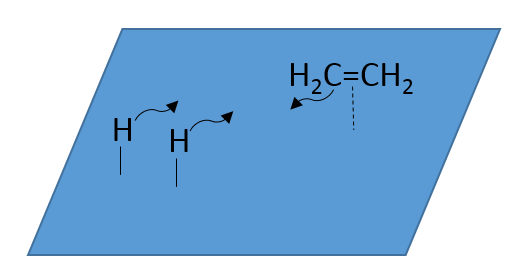
Adsorption et activation des réactif s: les espèces qui se trouvent dans le voisinage du catalyseur hétérogène peuvent se lier à lui. En terme d’entropie la liaison est assez neutre : les espèces proviennent d’un liquide à lier sur une surface où beaucoup de places sont possibles. Il existe donc un grand nombre de configurations possibles sur la surface.
Migration des réactifs sur la surface : les réactifs doivent être à proximité les uns des autres pour réagir ensemble
Réactions
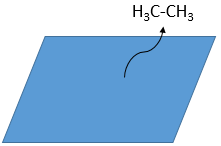
La désorption des produits
Dans le cas d’un catalyseur homogène le catalyseur est juste une espèce qui intervient au cours de la réaction mais non consommé par elle. Dans des niveaux élevés de l’atmosphère, le NO agit comme un catalyseur dans la destruction de l’ozone.
Le cas de la couche d’ozone :
La formule de l’ozone est O3. Cette molécule est sensible aux rayons UV qui la divise en O2 et un radical O.. Un radical est une espèce ou une molécule qui a des électrons de valence non appariés et qui est très réactif. Il est généralement le résultat d’une dissociation homolytique, à savoir les électrons de la liaison sont partagés de manière égale entre les deux atomes. Il est si réactif qu’il peut briser des molécules voisines pour former une liaison. Nous utilisons des radicaux pour produire des polymères (qui seront vus dans le chapitre correspondant) et aussi dans les produits antibactériens. Le bon point de l’utilisation de l’ozone comme un produit antibactérien est qu’il rejette l’oxygène O2 en tant que déchet, de sorte qu’il est propre pour l’environnement.
La destruction de l’ozone se fait en deux étapes : la première étape est la dissociation d’un radical O. sous le rayonnant de photons UV.
Le radical peut réagir avec l’O2 (réaction inverse) pour revenir à l’ozone ou de réagir avec une autre molécule d’ozone pour former plus d’O2.
Au total on obtient 3 O2 à partir de 2 molécules O3.
Le radical O. n’est pas un catalyseur de la réaction même si nous ne trouvons pas dans la réaction globale car elle est produite et consommée pendant la réaction. C’est une espèce qui est déjà présente dans le système dès le début et qui reste dans le système une fois que la réaction est terminée. La vitesse que nous trouvons expérimentalement est :
Ce n’est pas la vitesse que nous pourrions nous attendre d’une réaction en une seule étape. Nous pouvons faire l’analyse cinétique de la réaction. L’étape de détermination de cette réaction est la deuxième réaction.
La concentration du radical est difficile à déterminer mais nous pouvons encore faire les mêmes hypothèses que nous avons faites avec la réaction entre H2 et I2 : la concentration du produit intermédiaire ne change pas et la première réaction est à l’équilibre :
On peut insérer cela dans l’expression de la vitesse :
Freon’s
Freon’s are small species full of halogens, CCl2F2 for instance that have a very high heat capacity and are nonpolar and inert. There have been used as refrigerant in the fridges for a long time and we thought that, as those species were inert in the labs we had no specific care to apply to them. However Freon’s are deteriorated by UV rays. In dumps, the tubes containing the Freon eventually break and the gas goes up high in the atmosphere where it is not inert anymore. The deterioration of Freon’s due to UV’s leads to the formation of radicals that will interact with the ozone.
If we sum the two last equations, we get the determining step of the deterioration of the ozone alone.
The Cl. is thus a catalyst of the destruction of the ozone and the hole in the ozone layer started to grow. The problem is that the Freon gas takes a very long time (years) to reach the higher atmosphere and at the moment we observed their effect, a lot of Freon’s were already climbing. Now the use of Freon’s is forbidden and the hole in the ozone layer is slowly decreasing in size.
Another product having an effect on the ozone is some nitrogen products of the exhaust pipes of cars. During the combustion of the fuel, nitrogen monoxide and dioxide can be formed.
Nitrogen dioxide is deteriorated by light.
Low in the atmosphere, and at the ground level, NO acts as a catalyst and generates peaks of ozone. Higher, NO catalyses the destruction of the ozone.