Le cholestérol est sans doute le lipide le plus médiatisé en raison de la forte corrélation entre les taux élevés de cholestérol dans le sang et l’incidence des maladies cardiovasculaires chez l’homme . Moins bien connu est le rôle important du cholestérol en tant que composant des membranes cellulaires et en tant que précurseur des hormones stéroïdiennes et des acides biliaires. Le cholestérol est une molécule essentielle chez de nombreux animaux, y compris les humains, mais il n’est pas requis dans le régime des mammifères – toutes les cellules peuvent le synthétiser à partir de simples précurseurs. La structure de ce composé à 27 atomes de carbone suggère une voie de biosynthèse complexe, mais tous les atomes de carbone sont fournis par un seul précurseur (l’acétate)
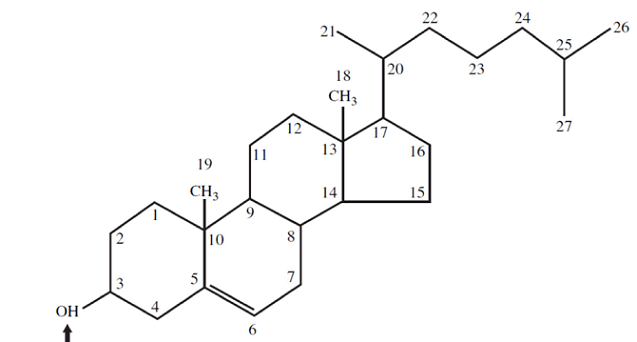
Les unités d’isoprène qui sont les intermédiaires essentiels dans la voie de l’acétate au cholestérol, sont également des précurseurs de nombreux autres lipides naturels et les mécanismes par lesquels les unités d’isoprène sont polymérisées sont similaires dans toutes ces voies. Nous commencerons par des étapes principales dans la biosynthèse du cholestérol à partir de l’acétate, puis étudierons les voies de biosynthèse de certains des nombreux composés dérivés des unités d’isoprène, qui partagent des étapes précoces avec la voie vers le cholestérol, illustrant l’extraordinaire polyvalence des condensations isoprénoïdes dans la biosynthèse. Le cholestérol est fabriqué à partir d’acétyl-CoA en quatre étapes, comme les acides gras à longue chaîne le cholestérol est fabriqué à partir d’acétyl-CoA, mais le plan d’assemblage est trèsdifférent. Dans les premières expériences, les animaux ont été nourris avec de l’acétate marqué au 14C soit dans le carbone méthylique, soit dans le carbone carboxyle. Le profil de marquage dans le cholestérol isolé des deux groupes d’animaux a fourni le plan d’élaboration des étapes enzymatiques de la biosynthèse du cholestérol. La synthèse se déroule en quatre étapes,
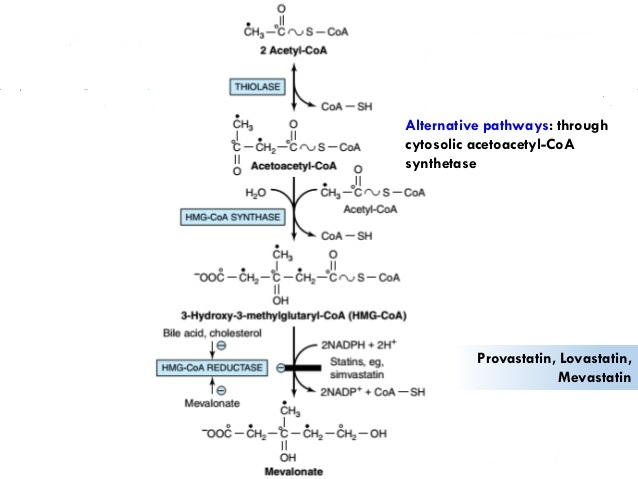
1) la condensation de trois unités d’acétate pour former un intermédiaire à six atomes de carbone, le mévalonate:
La synthèse du Mévalonate à partir de l’Acétate La première étape de la biosynthèse du cholestérol conduit au mévalonate. Deux molécules d’acétyl-CoA se condensent pour former de l’acétoacétyl-CoA, qui se condense avec une troisième molécule d’acétyl-CoA pour donner le composé à six carbones 3-hydroxy-3-méthylglutaryl-CoA (HMG-CoA). Ces deux premières réactions sont catalysées par la thiolase et la HMG-CoA synthase, respectivement. La HMG-CoA synthase cytosolique dans cette voie est distincte de l’isoenzyme mitochondriale qui catalyse la synthèse de l’HMG-CoA dans la formation de corps cétoniques. La troisième réaction est l’engagement et la limitation des taux étape: réduction de l’HMG-CoA en mévalonate, pour lequel chacune des deux molécules de NADPH donne deux électrons. HMG-CoA réductase, une protéine membranaire intégrale du réticulum endoplasmique lisse, est le point majeur de la régulation sur la voie vers le cholestérol ( mode d’action des statines), comme nous le verrons.
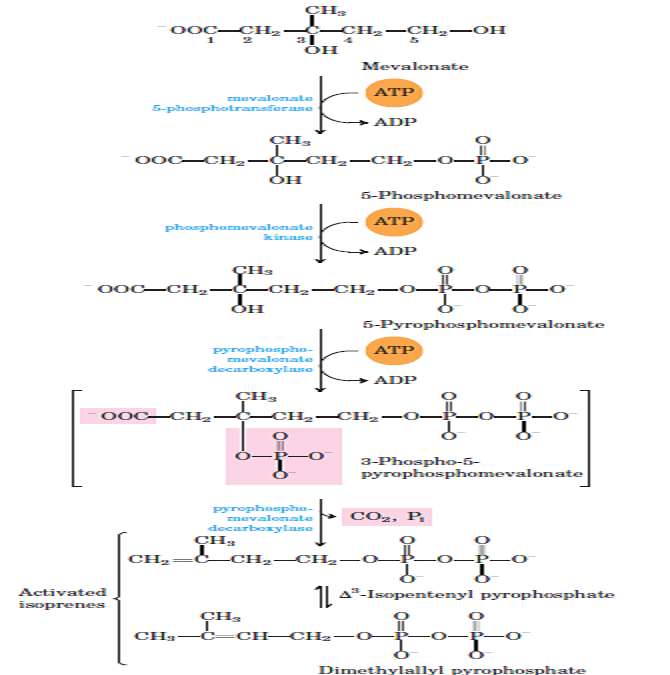
2 conversion du mévalonate en unités d’isoprène activé:
La conversion du maléate en deux isoprènes activés Dans l’étape suivante de la synthèse du cholestérol, trois groupes phosphate sont transférés de trois molécules d’ATP au mévalonate (figures 21-35). Le phosphate attaché au groupe hydroxyle C-3 du mévalonate dans le 3-phospho-5-pyrophosphomevalonate intermédiaire est un bon groupe partant; à l’étape suivante, à la fois cette phosphate et le groupe carboxyle voisin partent, produisant une double liaison dans le produit à cinq atomes de carbone, le 3-isopentényl pyrophosphate. C’est le premier des deux isoprènes activés au centre de la formation du cholestérol. L’isomérisation du ß-3-isopentényl pyrophosphate donne le second isoprène activé, le diméthylallyl pyrophosphate. La synthèse de l’isopentényl pyrophosphate dans le cytoplasme des cellules végétales suit la voie décrite ici. Cependant, les chloroplastes végétaux et de nombreuses bactéries utilisent une voie indépendante du mévalonate. Cette voie alternative ne se produit pas chez les animaux, c’est donc une cible intéressante pour le développement de nouveaux antibiotiques.
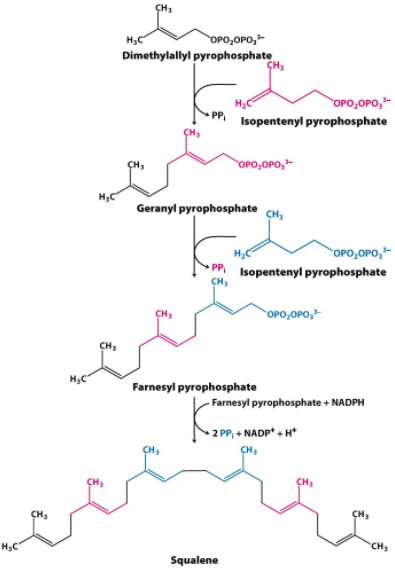
3 polymérisation de six unités d’isoprène à 5 atomes de carbone pour former le squalène linéaire à 30 atomes de carbone :
La condensation de six unités d’isoprènes activées pour former le squalène. L’isopentényl pyrophosphate et le diméthylallyl pyrophosphate subissent une condensation de tête à queue, dans laquelle un groupe pyrophosphate est déplacé et une chaîne de 10 carbones, le géranyl pyrophosphate, est formée . (Fig ci-dessous) . (La «tête» est l’extrémité à laquelle le pyrophosphate est joint.) Le pyrophosphate de géranyle subit une autre condensation de tête à queue avec l’isopentényl pyrophosphate, donnant le farnésyl pyrophosphate, intermédiaire à 15 atomes de carbone. Enfin, deux molécules de farnésyl pyrophosphate se joignent tête à tête, avec élimination des deux groupes pyrophosphates, pour former le squalène. Les noms communs de ces intermédiaires dérivent des sources d’où ils ont été isolés pour la première fois. Le géraniol, est un composant de l’huile de rose, a l’arôme des géraniums, et le farnesol est un composé aromatique trouvé dans les fleurs de l’acacia Farnese. De nombreux parfums naturels d’origine végétale sont synthétisés à partir d’unités d’isoprène. Le squalène, isolé pour la première fois du foie des requins (genre Squalus),contient 30 atomes de carbone, 24 dans la chaîne principale et 6 sous forme des groupes méthyles.
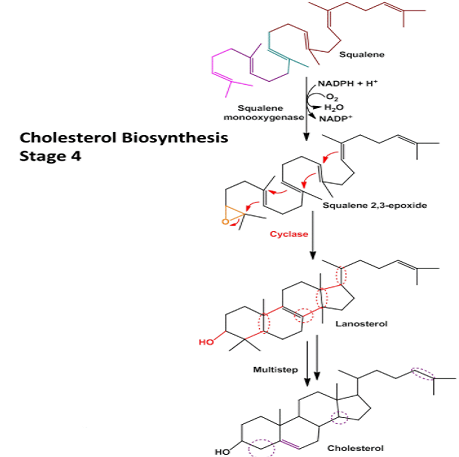
4 la cyclisation du squalène pour former les quatre anneaux du noyau stéroïdien, avec une autre série de changements (oxydations, élimination ou migration des groupes méthyle) pour produire du cholestérol.
Lorsque la molécule de squalène est représentée comme sur la figure ci dessous, la relation de sa structure linéaire avec la structure cyclique des stérols devient apparente. Tous les stérols ont les quatre anneaux fusionnés qui forment le noyau stéroïde, et tous sont des alcools, avec un groupe hydroxyle sur C-3 – d’où le nom « sterol ». L’action du squalène monooxygénase ajoute un atome d’oxygène à la fin de la chaîne de squalène ( atome d’oxygène provenant de O2), formant un époxyde. Cette enzyme est une autre oxydase à fonction mixte , Le NADPH réduit l’autre atome d’oxygène de O2 en H2O. Les doubles liaisons du produit, squalène Le 2,3-époxyde est positionné de sorte qu’une réaction concertée remarquable peut convertir l’époxyde de squalène linéaire en une structure cyclique. Dans les cellules animales, cette cyclisation entraîne la formation de lanostérol, qui contient les quatre anneaux caractéristiques du noyau stéroïdien. Lanostérol est finalement converti en cholestérol dans une série d’environ 20 réactions qui comprennent la migration de certains groupes méthyle et l’élimination des autres. L’élucidation de cette voie biosynthétique extraordinaire, l’une des plus complexes connues, a été réalisée par Konrad Bloch, Feodor Lynen, John Cornforth et George Popják à la fin des années 1950. Le cholestérol est la caractéristique des stérols des cellules animales; les plantes, les champignons et les protistes produisent d’autres stérols étroitement apparentés. Ils utilisent la même voie de synthèse jusqu’au squalène 2,3-époxyde, point auquel les voies divergent légèrement, produisant d’autres stérols, tels que le stigmastérol dans de nombreuses plantes et l’ergostérol dans les champignons.
Le cholestérol a plusieurs destins :
Une grande partie de la synthèse du cholestérol chez les vertébrés a lieu dans le foie. Une petite fraction du cholestérol qui s’y trouve est incorporée dans les membranes des hépatocytes, mais la plus grande partie est exportée sous l’une des trois formes suivantes: cholestérol biliaire, acides biliaires ou esters de cholestérol. Les acides biliaires et leurs sels sont des dérivés du cholestérol relativement hydrophiles qui sont synthétisés dans le foie et facilitent la digestion des lipides. Les esters de cholestérol sont formés dans le foie par l’action de l’acyl-CoA-cholestérol acyltransférase (ACAT). Cette enzyme catalyse le transfert d’un acide gras de la coenzyme A vers le groupe hydroxyle du cholestérol, convertissant le cholestérol en une forme plus hydrophobe. Les esters de cholestérol sont transportés dans des particules de lipoprotéines sécrétées vers d’autres tissus qui utilisent du cholestérol, ou ils sont stockés dans le foie. Tous les tissus animaux en croissance ont besoin de cholestérol pour la synthèse membranaire, et certains organes (la glande surrénale et les gonades, par exemple) utilisent le cholestérol comme précurseur de la production d’hormones stéroïdiennes (nous en discuterons plus loin). Le cholestérol est également un précurseur de la vitamine D.