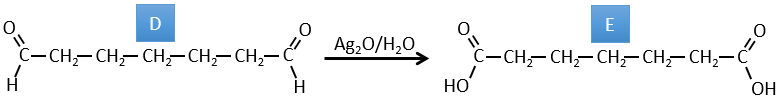Cette section fait partie intégrante du cours et contient quelques réactions qui n’ont pas été abordées dans le cours principal. Il est difficile de comprendre par vous-même certains mécanismes avec les conseils qui sont dans les exercices. Si vous ne réussissez pas, ne vous inquiétez pas. Les solutions et la description des réactions suivent directement chaque exercice. Cependant, les parties qui ont été vues dans le cours sont considérées comme connues et ne peuvent pas être expliquées en détail.
Le principe des exercices suivants est assez simple (mais les exercices ne le sont pas): Nous vous donnons une série de réactions qui se suivent mais nous ne vous donnerons que quelques-uns des réactifs et/ou des produits. De là, vous devez reconstruire tout le processus et découvrir quelle molécule et quelle structure se cachent derrière cette lettre.
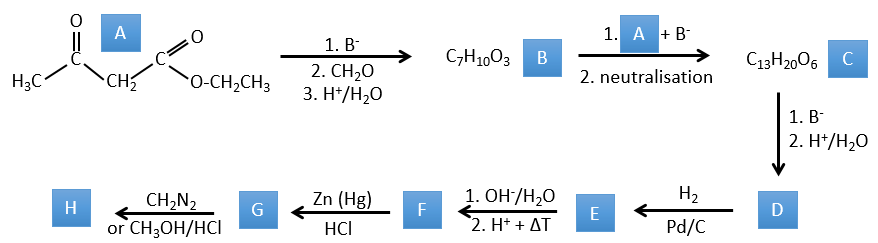
1. Dans ce premier exercice, vous avez la structure du réactif initial (A) et la composition du premier produit B. Vous devez déterminer la structure de B, le produit obtenu par la première réaction. Ensuite, à partir de B, vous devez déterminer la structure de C, puis le composé D et sa structure, etc.
Correction
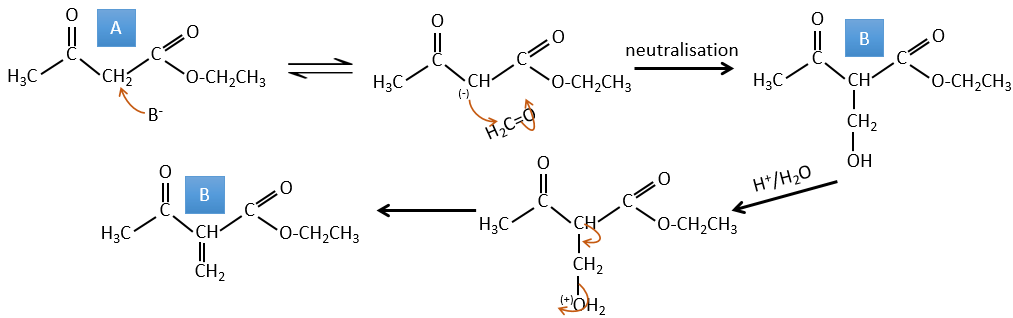
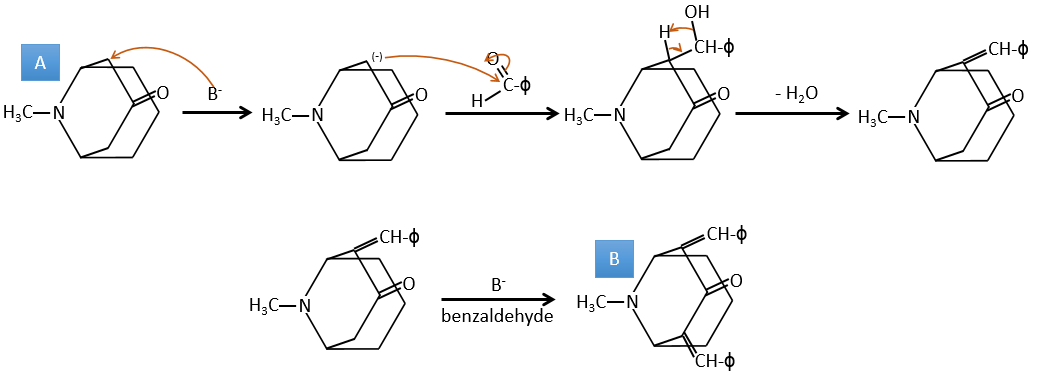
A → B: Deux ensembles de protons sont plus acides que les autres: les protons en α de carbonyle. Les protons de CH3 sont moins acides que le CH2 parce que CH2 est entre deux carbonyles. C’est là que la base attaque. Le carbone négatif attaque ensuite le formaldéhyde. Un réarrangement se produit après la neutralisation pour obtenir B et H2O.
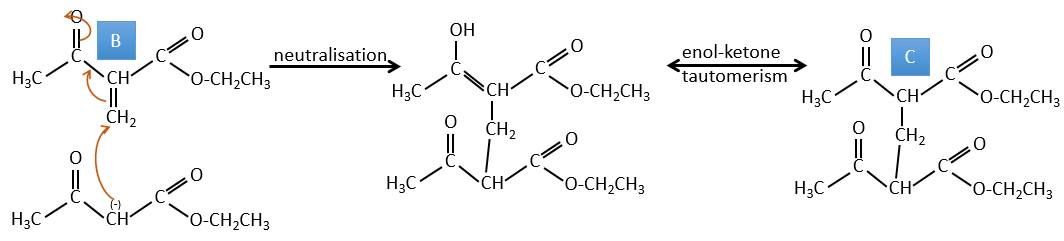
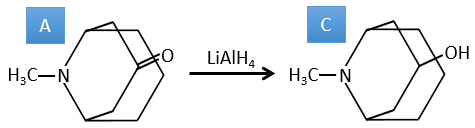
B → C: La première étape est identique à celle de la réaction précédente et les deux molécules se confondent. L’attaque se fait sur le carbone sp2 et on obtient une structure stabilisée par une liaison H formant un cycle entre l’OH et le C = O.
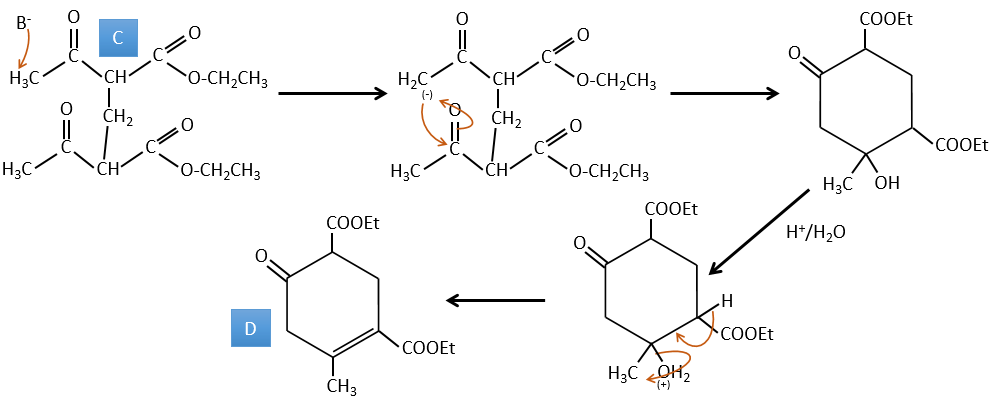
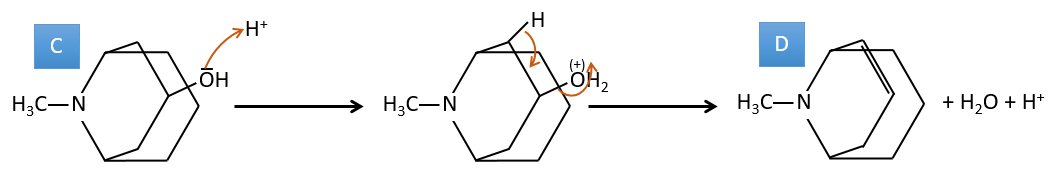
C → D: Cette fois, le proton (noté *) n’est pas attaqué par la base parce que l’élimination d’un proton méthylique permet la formation d’un cycle de 6 carbones. Dans la seconde étape, l’acide catalyse la perte d’une molécule d’eau pour obtenir une double liaison conjuguée au carbonyle.
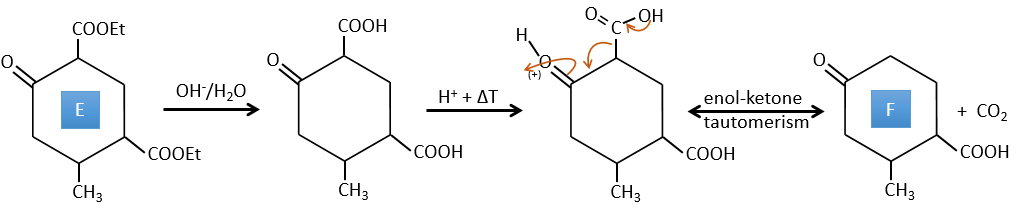
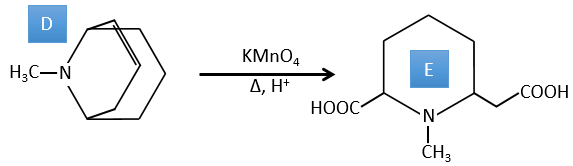
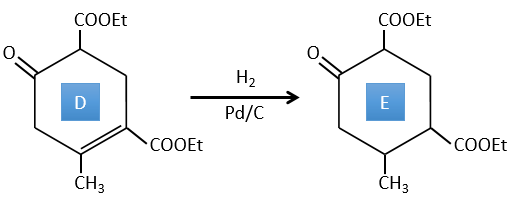
D → E: La double liaison est réduite pour obtenir un cyclohexane.
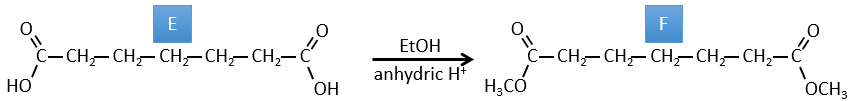
E→F:Les esters sont transformés en acides carboxyliques avec une catalyse basique. Le CO2 se détachera si on augmente la température.
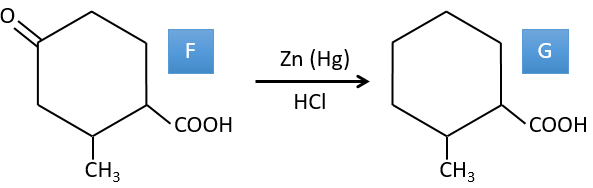
F→G: le Zn réduit sélectivement une cétone dans une chaîne alkyle.
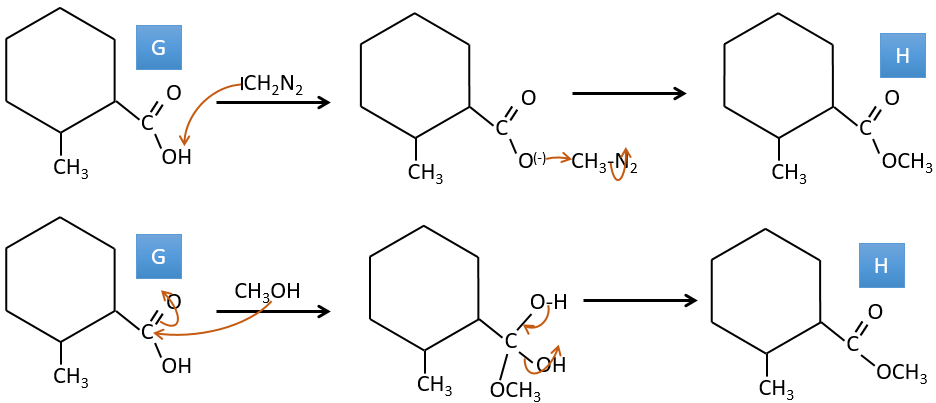
G→H: Le diazonium carbène est capable de prendre le proton de l’acide. Le carboxylate attaque ensuite le carbène pour former un ester méthylique et libérer N2. CH3OH conduit au même résultat mais le processus est différent: il y a une substitution nucléophile sur le carbonyle pour remplacer -OH par
-OCH3.
2. Cet exercice met l’accent sur les réactions concernant les produits aromatiques et les acides carboxyliques ainsi que leurs dérivés.
Correction
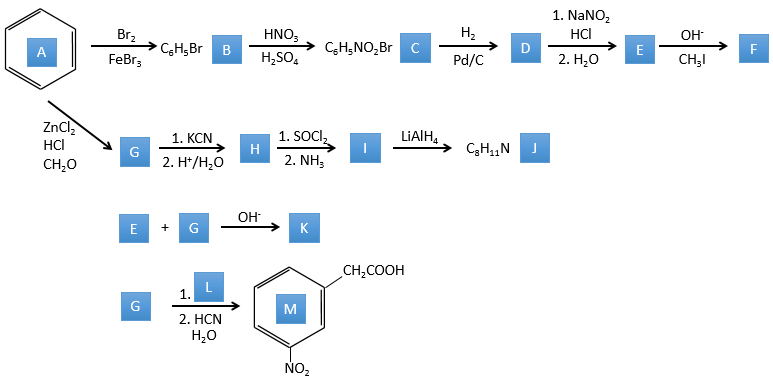
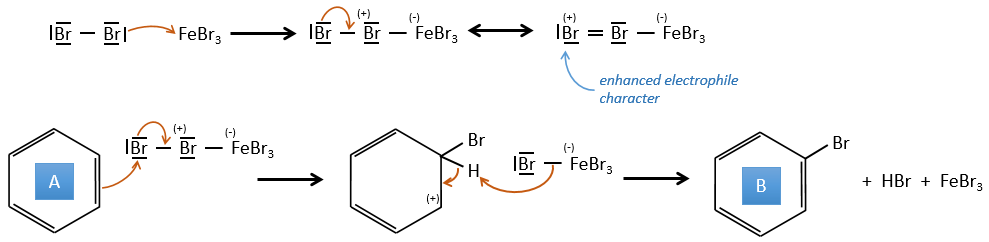
A→B: Le caractère électrophile de Br doit être renforcé par un acide de Lewis pour effectuer la réaction.
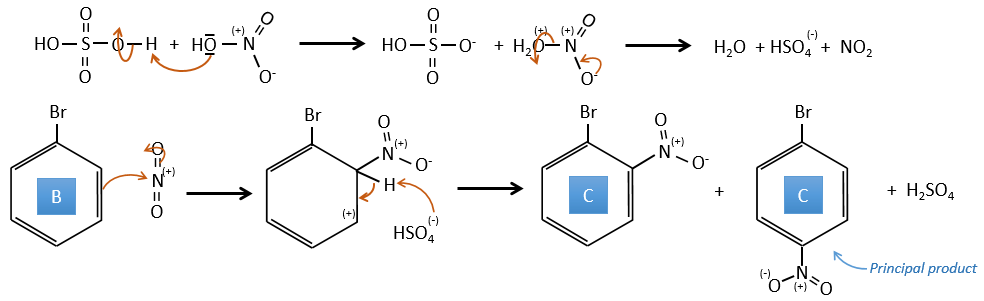
B→C: Un groupe nitro est ajouté au cycle. Il ya déjà un substituant sur le cycle donc nous devons déterminer si le groupe nitro est ajouté en ortho, méta ou para. Un halogène oriente la réaction sur les positions ortho / para. La position para doit être favorisée en raison de l’empêchement stérique sur la position ortho.
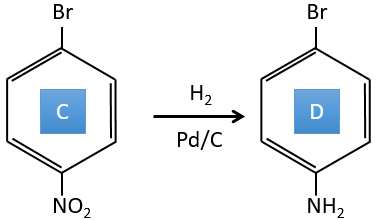
C→D: La réduction est limitée au groupe nitro qui se transforme en amine. Pour réduire complètement le cycle aromatique, nous devons chauffer la solution à 300 ° C.
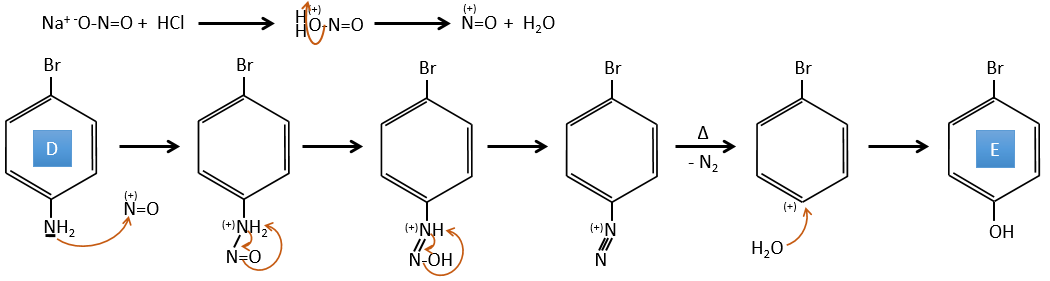
D→E: NaNO2 n’ajoute pas un groupe nitro sur l’anneau. Il conduit à l’élimination de l’aminé et à la formation d’un arénium. Cette espèce très réactive réagit avec l’eau pour remplacer l’aminé par un groupe hydroxyle -OH.
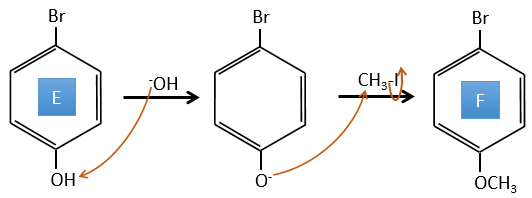
E→F: La base prend le proton du p-bromophénol. Il y a alors une attaque nucléophile par l’anion sur CH3I pour obtenir le p-bromométhoxybenzène.
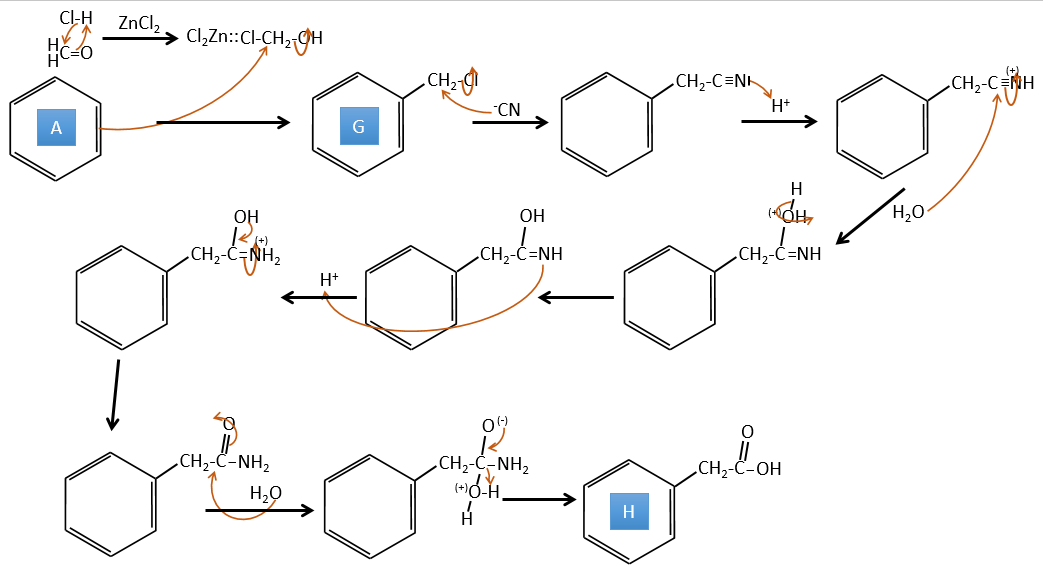
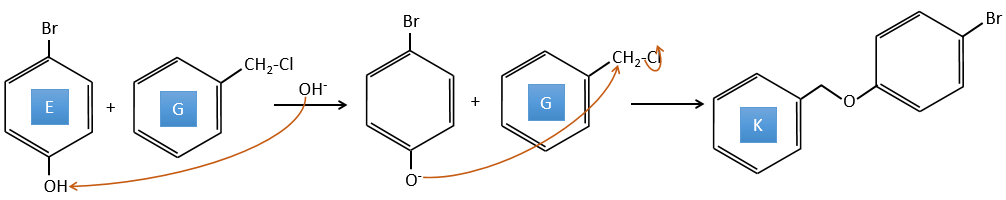
A→G: C’est la réaction de chlorométhylation. Au cours de cette réaction, le formaldéhyde et l’acide chlorydrique forment un chlorométhanol stabilisé par ZnCl2. L’acide protonne l’alcool et l’anneau peut l’attaquer pour rejeter l’eau et lier le CH2Cl.
G→H:Un simple SN2 par CN- suivi de sa transformation en un acide carboxylique. Cette transformation se fait par des attaques successives de molécules d’eau sur la liaison carbone à l’azote.
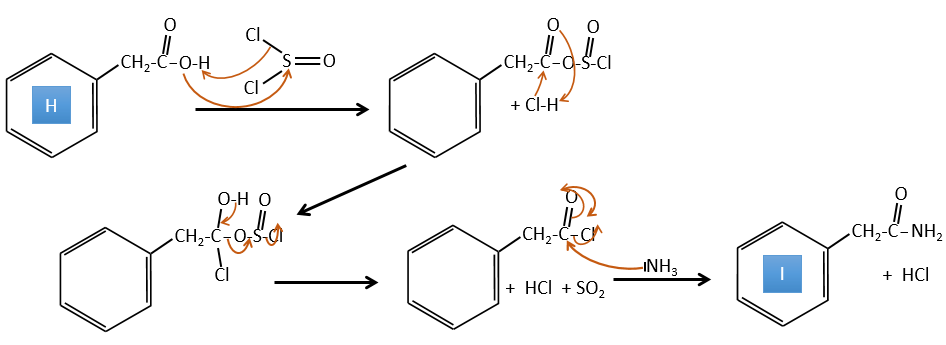
H→I: SOCl2 est une molécule qui nous permet d’obtenir un chlorure d’acyle à partir d’un acide. Cela ne peut pas être fait avec HCl ou Cl2 car Cl- est un meilleur groupe partant que OH-. La réaction est suivie de la formation d’un amide primaire.
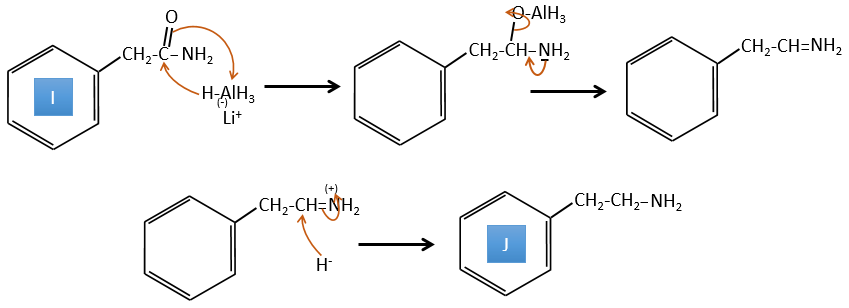
I→J:L’amide est réduit en une amine par LiAlH4. LiAlH4 peut générer H- qui attaque le carbonyle.
E+G→K: Une base prend le proton du bromophénol pour obtenir un nucléophile plus fort. IN SN2 a lieu entre les deux espèces pour les fusionner en une seule molécule.
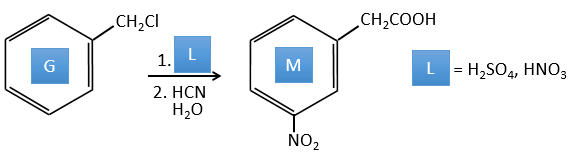
G→M: La seconde étape de la réaction conduit à la formation de l’acide carboxylique comme c’était le cas dans la réaction G-> H. L’élément manquant sur M est le groupe nitro en méta. Cette position est favorisée en raison de l’effet de capteur mésomère du COOH à travers le CH2. L’effet est toutefois plus faible que pour un capteur mésomère directement en contact avec le cycle aromatique.
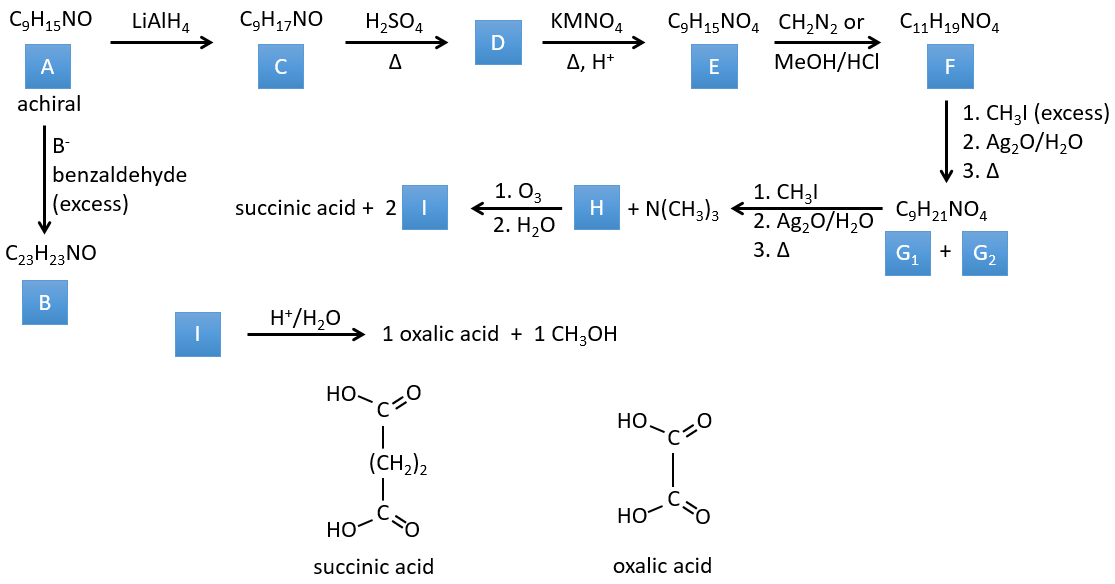
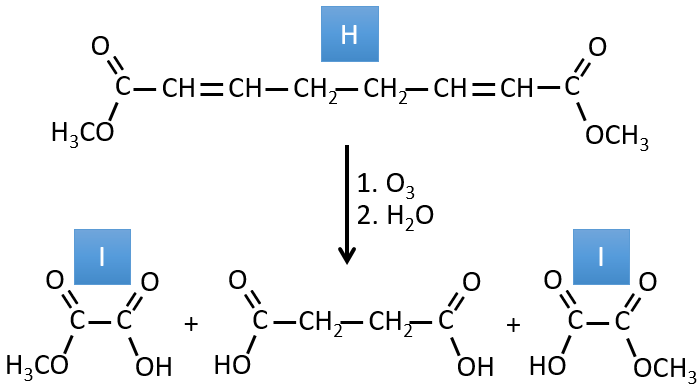
3. Dans cet exercice, le dernier produit d’une longue série de réactions est donné. C’est le produit direct d’une réaction d’ozonolyse. Vous devez donc revenir en arrière dans les réactions, à partir de la fin pour trouver les réactifs de chaque réaction. Les formules de la plupart des molécules sont données. G1 et G2 sont des isomères.
Correction
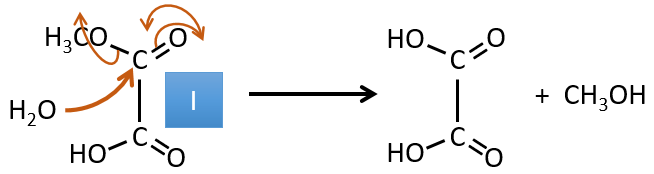
I→…:L’un des produits, l’acide oxalique, est un acide carboxylique et un réactif est l’eau. On peut donc deviner que la réaction est une réaction de substitution sur un dérivé de l’acide carboxylique. L’autre produit de la réaction est une molécule de méthanol. Un acide carboxylique était donc un ester avant la réaction. Un seul méthanol est généré par la réaction, de sorte qu’un seul des deux acides de l’acide oxalique était un ester.
H→I: L’ozonolyse coupe une molécule à double liaison et conduit à la formation d’acides carboxyliques en présence d’un oxydant. Il y a 4 groupes acides dans les produits de cette réaction et 2 esters. Les 4 groupes acides indiquent qu’une plus grande molécule a été coupée à deux endroits. Les doubles liaisons ont été ainsi conjuguées avec les esters. C’est donc un exemple de réaction qui implique une partie du système conjugué et pas tout. Nous ne savons pas si les doubles liaisons sont cis ou trans.
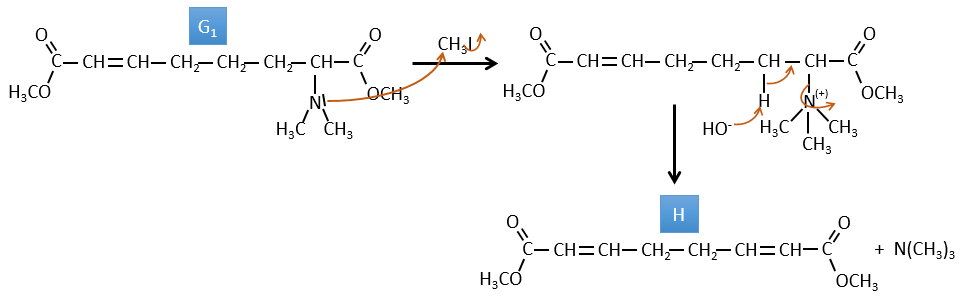
G→H: G1 et G2 sont deux isomères. Il y a deux autres informations que nous pouvons considérer pour trouver les isomères. CH3I, Ag2O et delta sont les réactifs de la réaction de Hoffmann. Cette réaction brise une liaison C-N et forme une double liaison sur ce carbone. C’est donc l’une des liaisons pi que l’azote était liée. La deuxième information est que l’azote n’est plus sur le produit, ce qui signifie qu’il n’avait qu’une seule liaison avec la chaîne. Le deuxième produit de la réaction, N(CH3)3N, le confirme. Les deux isomères sont donc différents du carbone sur lequel N(CH3)2 était lié. Il peut s’agir du carbone en α ou en β du carbonyle.
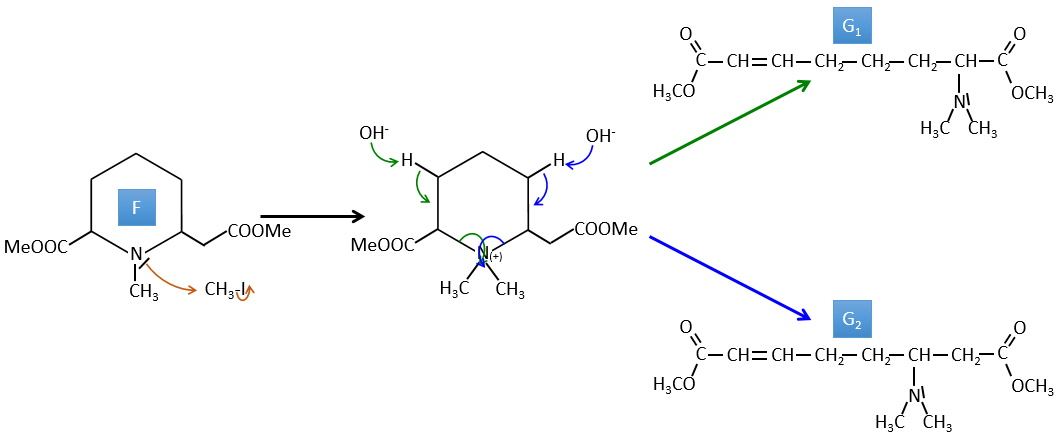
F→G: C’est la même réaction que G-> H mais l’azote est toujours sur la molécule après la réaction. Cela signifie qu’il était lié ailleurs sur la molécule. L’emplacement est l’endroit où se trouve la liaison pi. La molécule avait donc un cycle de 6 atomes avant la réaction. Contrairement à l’espèce H, le cycle F n’est pas symétrique. C’est pourquoi nous pouvons obtenir deux isomères G1 et G2.
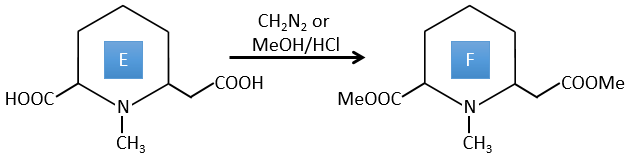
E→F: CH2N2 and MeOH/HCl sont deux techniques pour remplacer un acide carboxylique par un ester méthylique. L’espèce E a donc deux acides carboxyliques.
D→E: KMnO4 agit comme l’ozone. Les deux acides carboxyliques forment ainsi un pont du cycle. Ce pont forme également un cycle de 6 atomes du côté de l’azote (et un cycle de 8 carbones avec l’autre côté).
C→D: Si l’on vérifie les compositions du réactif C et du produit D, on voit qu’il y a une différence de H2O. Le rôle de H2SO4 était donc d’éliminer cette molécule d’eau de C avec la formation d’une double liaison. Le groupe hydroxyle pourrait être à deux endroits (dans α ou β des carbones pontés). À ce stade, nous ne pouvons pas dire quelle est la position correcte, mais la réaction A-> B n’est possible qu’avec le groupe hydroxyle dans β du carbone ponté. L’espèce est donc symétrique et achirale comme l’espèce A.
A→C: Une réaction classique de réduction. A obtient H2 dans le processus et nous pouvons supposer que le groupe hydroxyle était une cétone avant la réduction.
A→B: La base est là pour retirer un proton en α de carbonyle. Ces protons sont acides en raison de la tautomérie énol-cétone. Le carbanion attaque un benzaldéhyde sur son carbonyle et l’eau est perdue après cette attaque. La double liaison est en α de carbonyle et forme une longue chaîne de résonance avec le phényle. Cette réaction peut être répétée de l’autre côté du carbonyle pour obtenir le produit B.
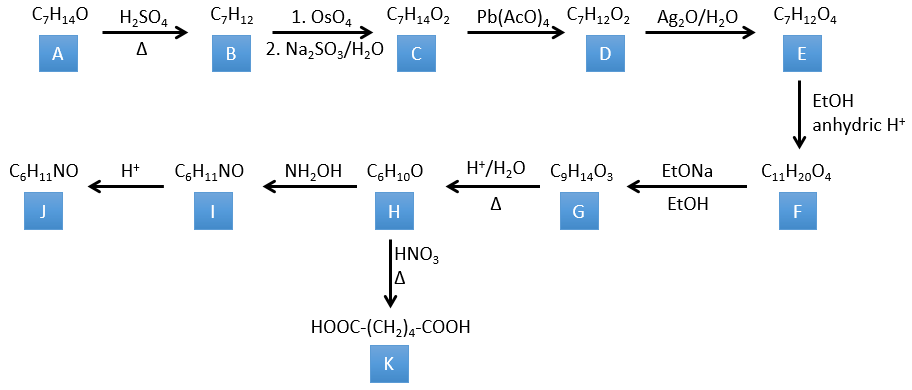
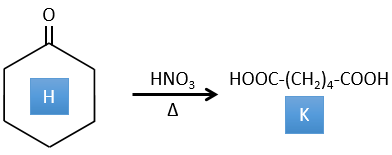
4. Il y a quelques réactions spécifiques dans cet exercice (principalement BàE). Vous avez les formules de tous les composés mais seulement la structure du composé K pour commencer. HNO3, ΔT est un réactif qui rompt la liaison C-C d’une cétone pour obtenir deux acides carboxyliques. Le mécanisme est inconnu.
Correction
H→K: Comme expliqué dans le libellé, HNO3 casse une cétone en deux acides. Comme les deux acides sont présents dans le produit, H est un cycle avec une cétone. Le cycle a 6 carbones.
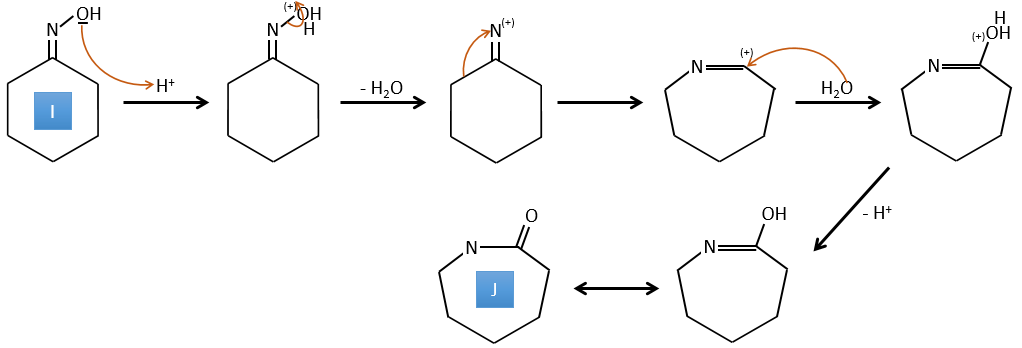
H→I: Cette réaction conduit à la formation d’un oxime, c’est-à-dire une base de Schiff où R = OH. Le mécanisme implique une substitution nucléophile par l’azote sur le carbonyle pour rejeter une molécule d’eau.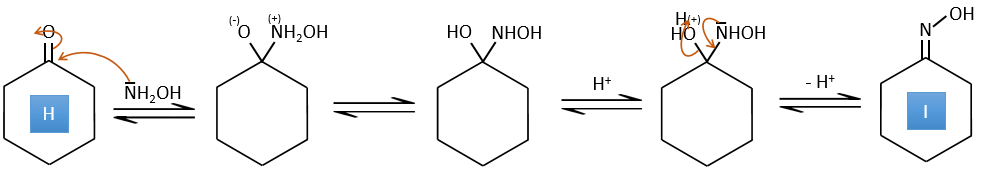
I→J: Cette réaction est la transposition de Beckmann. Dans des conditions acides, le OH de l’oxime est protoné et l’eau est libérée. L’azote cationique est ensuite attaqué par un carbone en alpha de l’oxime, plaçant l’azote dans la chaîne. L’eau revient attaquer le carbocation et former un amide.
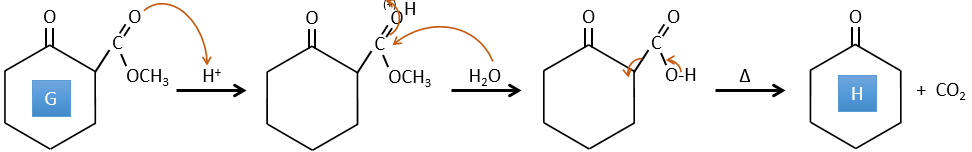
G→H: Une réaction simple pour changer un ester en acide carboxylique. Le groupe est ensuite retiré de la molécule par une élévation de température.
F→G: Un proton en α sur carbonyle est pris par la base forte. L’anion formé attaque ensuite l’ester pour former un cycle de 6 carbones portant une cétone et un ester méthylique.
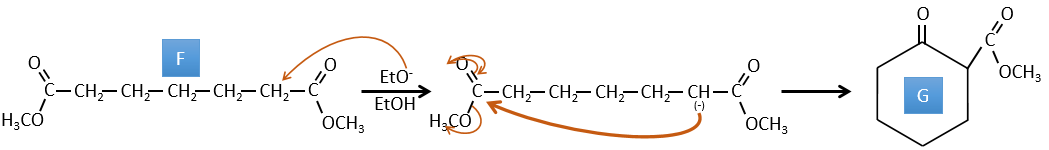
E→F: Les acides carboxyliques sont remplacés par des esters méthyliques
D→E: Ag2O est capable d’oxyder un aldéhyde en un acide carboxylique.
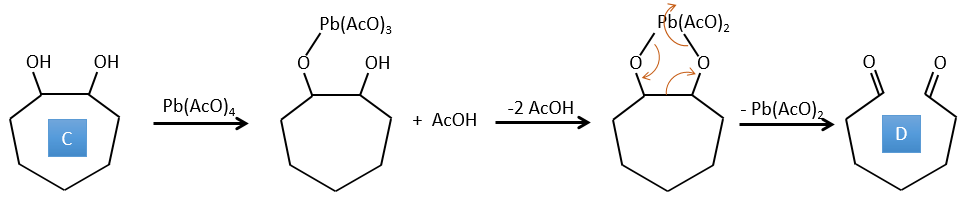
C→D: Le Pb(AcO)4 est un composé qui réagit avec les cis-glycols. Le Pb échange un équivalent d’acide acétique pour se lier à un oxygène. Le processus est lent mais il se liera également avec le second OH pour former un cycle de 5 atomes. Ce cycle se brise pour générer 2 cétones qui sont maintenant séparées. Le même mécanisme est obtenu avec HIO4. Comme il n’y a qu’un seul produit, le réactif est donc un cis-glycol cyclique.
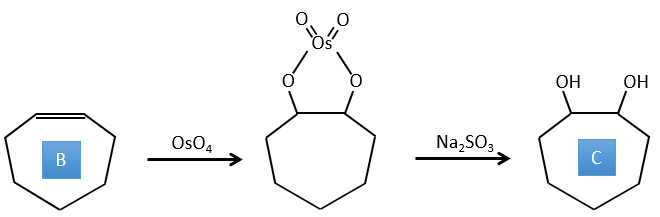
B→C: Le tétroxyde d’osmium est un réactif qui affecte spécifiquement C = C et qui génère un ester osmique, un peu comme le complexe formé par Pb(AcO)4 avec le cis-glycol. Na2SO3/H2O élimine l’osmium de la molécule pour obtenir le cis-diol. KMnO4 peut faire la même chose mais nous devons être dans des conditions basiques ou froides ou nous obtiendrons un diacide. Le réactif est donc un cycle de 7 carbone avec une double liaison entre deux des carbones.
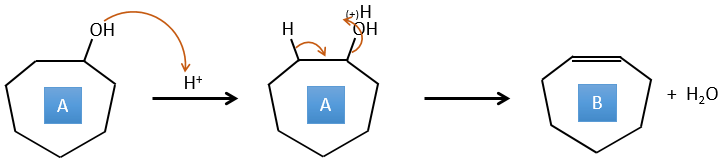
A→B: Cette réaction est simplement l’élimination d’une molécule d’eau du cycle qui donne une double liaison. On peut en déduire la différence de composition entre le réactif et le produit: C7H14O-C7H12=H2O.
A→G: C’est la réaction de chlorométhylation. Au cours de cette réaction, le formaldéhyde et l’acide chlorydrique forment un chlorométhanol stabilisé par ZnCl2. L’acide protonne l’alcool et l’anneau peut l’attaquer pour rejeter l’eau et lier le CH2Cl.
G→H: Un simple SN2 par CN– suivi de sa transformation en un acide carboxylique. Cette transformation se fait par des attaques successives de molécules d’eau sur la liaison carbone à l’azote.
H→I: SOCl2 est une molécule qui nous permet d’obtenir un chlorure d’acyle à partir d’un acide. Cela ne peut pas être fait avec HCl ou Cl2 car Cl– est un meilleur groupe partant que OH–. La réaction est suivie de la formation d’un amide primaire.
I→J: L’amide est réduit en une amine par LiAlH4. LiAlH4 peut générer H– qui attaque le carbonyle.
E+G→K: Une base prend le proton du bromophénol pour obtenir un nucléophile plus fort. IN SN2 a lieu entre les deux espèces pour les fusionner en une seule molécule.
G→M: La seconde étape de la réaction conduit à la formation de l’acide carboxylique comme c’était le cas dans la réaction G-> H. L’élément manquant sur M est le groupe nitro en méta. Cette position est favorisée en raison de l’effet de capteur mésomère du COOH à travers le CH2. L’effet est toutefois plus faible que pour un capteur mésomère directement en contact avec le cycle aromatique.