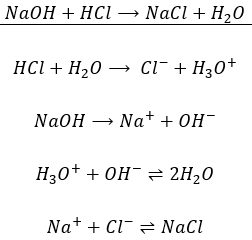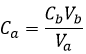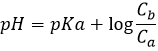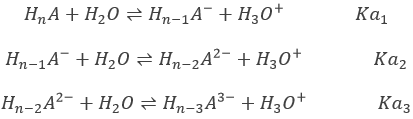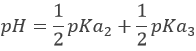Neutralisation:
Une réaction de neutralisation est la réaction qui a lieu entre un acide et une base formant un sel et de l’eau.
Techniquement la neutralisation n’est pas une réaction à une seule étape, en ce sens que toutes les mesures ne sont pas effectuées simultanément mais pas à pas. La première étape est la dissociation de l’acide et de la base à partir de leurs espèces conjuguées. La deuxième étape est la formation du sel à partir des espèces conjuguées et de l’eau à partir de H3O+ et de OH–. Par exemple NaOH est neutralisé par HCl pour former NaCl (sel de cuisine) et de l’eau.
La première équation est en effet l’addition des quatre équations situées en dessous. Si un composé se trouve des deux côtés de l’équation, comme les espèces ioniques, nous ne les écrivons pas dans l’équation moyenne. Notez que toutes les molécules de Na+ et de Cl– ne réagissent pas pour donner NaCl. Il y a ici un équilibre entre les espèces en solution et la précipitation du sel. Cet équilibre doit être vu dans la section de la dissolution.
Le point de neutralisation est atteint lorsque les quantités d’acide et de la base mises en solution sont égales. Tous les réactifs sont consommés et ensuite pour cette réaction, le pH est neutre c-à-dire pH = 7.
Titrage des acides et bases fortes :
Le titrage est une méthode utilisée pour déterminer la concentration d’un composé à travers sa neutralisation. Par exemple la concentration d’une solution d’HCl peut être déterminée par l’addition d’une solution de NaOH. La concentration de la solution de titrage est connue. Comme nous sommes en présence d’un acide fort (HCl) et d’une base forte (NaOH), les 2 produits seront complètement dissociés en solution. Dans HCL La concentration en protons est initialement équivalente à la concentration en Cl-. Dans l’autre solution, la concentration en OH- et en Na+ est aussi équivalente.
Pour obtenir un pH neutre le nombre de protons na (en moles) doit être égal au nombre de OH–, nb (en moles). En d’autres termes la neutralisation ou l’équivalence, est atteinte lorsque :
Le nombre de moles d’un composé dans une solution n’est que la concentration de cette espèce multiplié par le volume de la solution :
A partir des deux relations précédentes nous pouvons trouver la concentration initiale de l’acide que nous voulions déterminer :
A titre d’exemple, si 20 ml de NaOH 0,01 M a été nécessaire pour neutraliser un volume de 10 ml de la solution de HCl, alors [HCl] = 0,02 M.
Au laboratoire, les titrages sont effectués comme suit :
Un ballon contenant un volume donné de la solution inconnue est placé sur un agitateur magnétique. La puce magnétique est placé dans la solution pour mélanger de façon continue pendant l’expérience. Pour pouvoir observer le processus de neutralisation deux gouttelettes d’indicateur de pH sont ajoutées à la solution. Plusieurs indicateurs peuvent servir à observer le passage à travers pH = 7. Ici, nous allons utiliser le bleu de bromothymol dont la couleur passe du jaune (pH <6,0) au bleu (pH> 7,6). A pH = 7, la couleur est le vert. Considérant l’exemple précédent notre solution est donc jaune. On peut déjà dire que la solution est acide et que son pH est inférieur à 6.
La solution de neutralisation NaOH 0,01M, dans notre cas, remplit une burette placée quelques centimètres au-dessus de l’autre solution. Il n’y a pas besoin d’ajouter un indicateur de couleur dans cette solution. Manipulant avec soin la burette NaOH est ajouté lentement à la solution acide. On peut lire le volume consommé de la base sur les graduations de la burette. Lorsque le pH se rapproche de 6 on peut voir les gouttelettes de base tourne au bleu tout en se mélangeant dans la solution. Ne connaissant pas du tout la concentration de l’acide il est commode d’effectuer une expérience rapide pour déterminer un volume approximatif pour la neutralisation et d’effectuer une seconde expérience, en allant lentement à l’approche de ce volume. Typiquement la couleur passe du jaune au vert ou directement au bleu à la chute d’une gouttelette. La précision de cette expérience est donc limitée à la précision de la burette. En général le volume d’une gouttelette est la moitié d’une graduation.
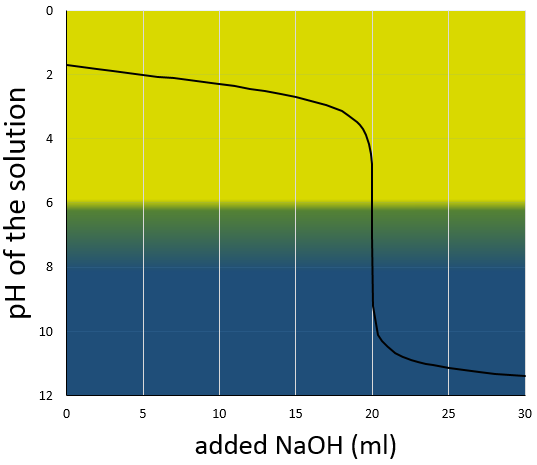
La courbe de titrage de cet exemple est représenté ce dessous.
Rappelons que le pH est le logarithme de la concentration des protons alors que l’addition de la base est linéaire et que le volume de solution augmente avec l’addition de la base (ne pas oublier ce point lors du choix du volume de la fiole). Comme nous pouvons le voir la variation de pH se concentre principalement au voisinage du point de neutralisation. À 20 ml, pH = 7 mais à 19.95ml (un gouttelette de moins environ, pour une burette de 50ml), pH = 4,78 et au 20.05ml, pH = 9,22.
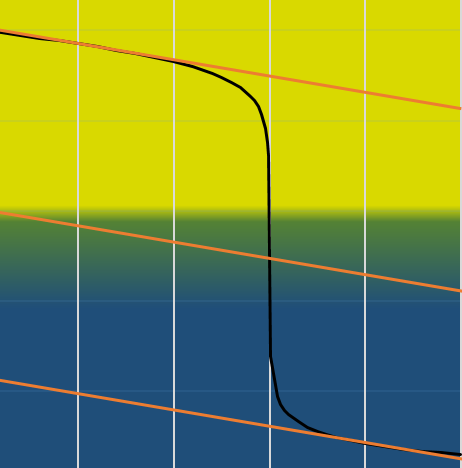
Nous pouvons également trouver le point d’équivalence en traçant les tangentes de la courbe dans la région acide et dans la région basique. Ces deux tangentes sont parallèles. Lorsque nous traçons la ligne équidistante à ces deux lignes, elle rencontre le point d’équivalence.
Titration des acides et bases faibles :
Le titrage d’un acide faible est effectué en utilisant une base forte et suit le même principe qu’en haut. Prenenons comme exemple le titrage de l’acide acétique la réaction est :
Cette réaction est complète. Avant le titrage le pH de la solution d’acide acétique est simplement donnée par la relation d’un acide faible que nous avons vu dans la section précédente :
En ce qui concerne les acides forts, l’équivalence est atteinte lorsque :
Cependant le pH à l’équivalence n’ est pas neutre mais basique. En effet, les espèces conjuguées d’une base/acide forts sont inertes mais les espèces conjugués d’un acide / base faibles sont eux-même une base / acide faibles : pKa + pKb = 14. Tout l’acide acétique et NaOH sont consommés mais acétate a été produite et c’ est une base faible.
Avant l’équivalence, le pH dépend de la quantité d’acide faible et de sa base conjuguée :
Ce mélange entre un acide faible et sa base conjuguée est appelé une solution tampon car l’addition d’une base forte ou d’acide ne modifie pas sensiblement le pH de la solution. Les solutions tampons sont très importantes pour les espèces vivantes qui les aident à résister à des variations brutales de l’environnement. Un exemple de solution tampon est l’estomac. Peu importe ce que nous mangeons ou buvons son pH n’est presque pas affecté de sorte que le travail peut être fait. Dans notre corps les enzymes sont efficaces dans une région donnée du pH et pour les garder efficaces le pH doit être maintenu dans ces zones par des solutions tampons.
La semi-équivalence est le moment où il y a autant de CH3COOH que CH3COO–(Ca=Cb). À ce stade pH=pKa. Pour atteindre le point semi-équivalant le volume supplémentaire de base est la moitié du volume pour obtenir l’équivalence. A l’équivalence le pH est donné par la quantité d’acétate dans la solution (formule pour une base faible). Cette quantité est égale à celle de NaOH ajouté à la solution.
Après le point d’équivalence le pH est donné par la quantité de NaOH dans la solution.
Le titrage d’un polyacide :
Considérons un polyacide HnA (un exemple concret sera donné plus loin) avec assez de différents pKa, la neutralisation des différentes formes de l’acide sont successives: la OH– d’abord va neutraliser les protons libérés par HnA puis les protons libérés par Hn-1A– etc…..
Le pH initial de la solution est le pH deHnA. Les concentrations des acides suivants sont négligeables. HnA peut être un acide fort ou un acide faible.
Au premier point d’équivalence Hn-1A– est la principale espèce en solution. C’ est une espèce amphotère c’est à dire qu’il peut accepter ou donner des protons. Le pH est ainsi :
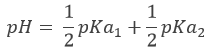
Au point de semi-équivalence suivant,[Hn-1A–]=[Hn-2A2-] et nous sommes dans une solution tampon. Rappelez-vous que le pH dans des solutions tampons est
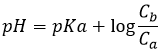
Le pH est donc pH =pKa2. Notez que si l’acide initial est un acide faible la même chose est vraie pour le premier point de semi-équivalence, à savoir pH =pKa1. Il est intéressant de noter que, pour ces valeurs particulières, le pH ne dépend pas de la concentration.
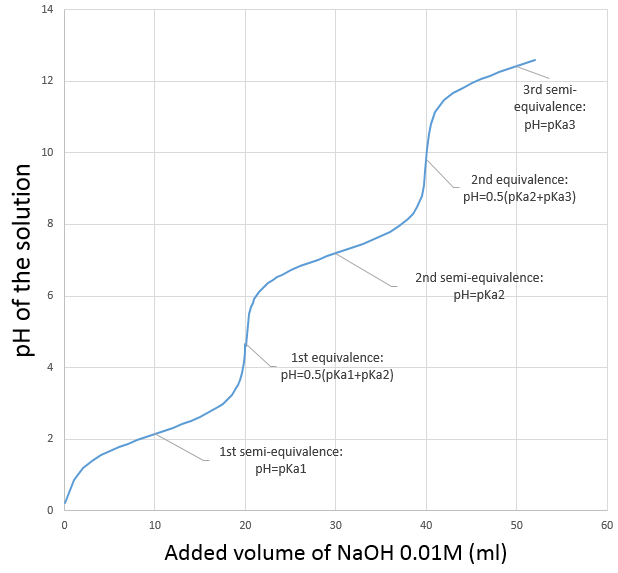
Prenons le cas de H3PO4 à titre d’exemple. Ses pKa sont très différents les uns des autres
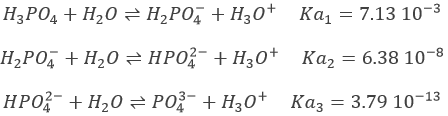
Les neutralisations sont successives et nous pouvons ainsi trouver les points spécifiques (semi-équivalences et équivalences) déterminés ci-dessus.
H3PO4 est un acide faible. Le pH initial de la solution est donc :
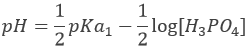
Avant l’équivalence, H3PO4 et H2PO4– sont en solution. Cette solution tampon a un pH de :
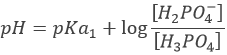
Avec pH = pKa1, lorsque [H3PO4] = [H2PO4–], à la mi-équivalence.
Lors de la première équivalence, H2PO4– est la principale espèce en solution. C’ est une espèce amphotère et le pH sera par conséquent:
Après la première équivalence, H2PO4– et HPO42- sont en solution. C’ est encore une solution tampon.
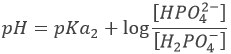
Avec pH = pKa2 lorsque [H2PO4–] = [ HPO42-], soit à la deuxième demi-équivalence. Au deuxième point d’équivalence HPO42- est la principale espèce en solution et est amphotère.
Après cette équivalence, la solution est à nouveau une solution tampon.
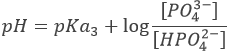
Avec pH = pKa3 lorsque [HPO42-] = [PO43-] c’ est à dire à la troisième demi-équivalence. Lors de la troisième équivalence PO43- est la principale espèce en solution. Ce n’ est pas une espèce amphotère mais une base faible. Le pH doit être
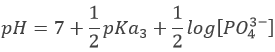
Cependant, Ka3 est très proche de Kw . Les protons libérés par l’eau sont en concurrence avec des protons de HPO42- et la prédiction n’est plus possible. Pour calculer le pH nous devons revenir à la composition complète de la solution puis résoudre l’équation. Ce ne sera pas fait ici.
Exercices:
1) Quelle est la couleur du bleu de bromothymol dans une solution de 20 ml de NaOH 0,005 M ? Si l’on ajoute 10 ml, 20 ml ou 30 ml de HCl 0,005 M?
2) Quelle est la couleur du bleu de bromothymol dans une solution de 20 ml de H3PO4 0,1 M ? Si l’on ajoute 10 ml, 20 ml ou 30 ml de NaOH 0,1 M?
Réponses:
1) 0 ml : bleu (pH = 11,7), 10 ml : bleu (pH = 11,22), 20 ml : vert (pH = 7), 30 ml : jaune (pH = 3).
2) 0 ml : jaune (pH = 1,57), 10 ml : jaune (pH = 2,147 pKa1), 20 ml : jaune (pH = 4,67), 30 ml : vert (pH = pKa2 = 7,2).
Article traduit de l’anglais ( cf site de BORZUYA en anglais )