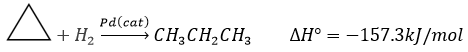Cycloalkanes
Un cycloalcane est, comme son nom l’indique, une chaîne alcane cyclique. Chaque carbone de la chaîne est lié à (au moins) deux atomes de carbone et deux atomes d’hydrogène. La formule générale est donc CnH2n et le nom du composé est le même nom que l’alcane correspondant avec le préfixe cyclo.
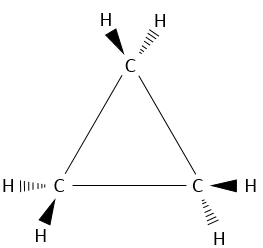
Cyclopropane
Le plus petit cycle « cyclopropane est fait de trois atomes de carbone. Chaque carbone est lié aux deux autres avec une forme de triangle.
Cela veut dire que les atomes de carbone sont dans le même plan et que l’angle entre les liaisons est de 60°, cet angle est loin de l’angle normal entre les liaisons des alcanes. Rappelez-vous que les carbones ont une structure tétraédrique avec un angle de 109,5° entre chaque liaison. Pour être cyclique, il existe une déformation de la structure de carbone et une tension est maintenue dans la forme de cycle. Il est possible de déterminer l’importance de cette tension à partir de l’énergie de combustion ΔH°comb du cycloalcane.
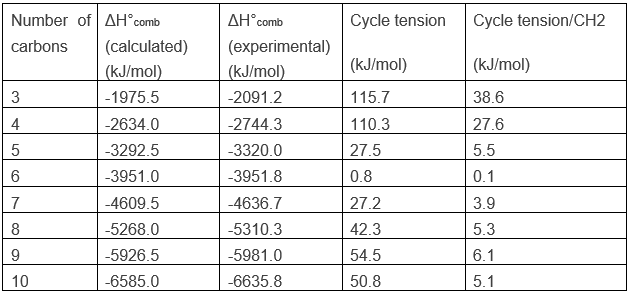
Pour un alcane linéaire la chaleur de la combustion augmente d’environ 658.5kJ/mole lorsque la longueur de la chaîne est augmentée d’une unité. On peut en conclure que le ΔH°comb moyenne d’un CH2 est 658.5kJ/mol. L’application de cela au cyclopropane, C3H6, donne un ΔH°comb calculé de -1975.5kJ/mol. Cependant, lorsque nous effectuons expérimentalement la combustion, nous constatons que AH°comb est égale à -2091.2kJ/mol.
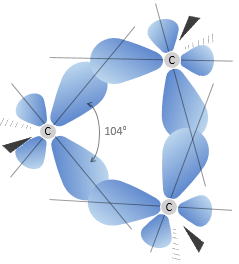
Les cyclopropanes libèrent ainsi plus de chaleur que ce que nous pouvions espérer. La différence, 115.7kJ/mol (38.6kJ / mol / CH2), vient de la tension du cycle, c’est-à-dire que la molécule nécessite plus d’énergie pour cette forme de liaison. En fait les orbitales du carbone ne sont pas bien alignées, mais l’angle entre les orbitales est 104°.
En conséquence, les liaisons sont faibles et le cyclopropane n’est pas très stable. Il est en effet facilement transformé par hydrogénation catalytique.
Enfin, la position des atomes d’hydrogène est défavorable. Ayons un rappel rapide des conformations éclipsées et décalées pour les hydrogènes dans de l’éthane (C2H6). L’hydrogène peut tourner autour de l’axe formé par la liaison CC. Chaque hydrogène a un volume donné et sent les atomes dans son voisinage (encombrement stérique). Lors de la rotation, pour une H donnée, la distance avec les hydrogènes les plus proches portés par des autres carbones changent.
Sur la projection Newman :
-les hydrogènes sont sur les mêmes points et sont considérés éclipsés (eclipsed)
– ou ils ne sont pas sur les mêmes points, c’est ce qu’on appelle en quinconce (staggered)
Un maximum d’énergie est atteinte dans la conformation de l’éclipse parce que la répulsion entre les atomes d’hydrogène est maximale dans de cette conformation. Pour maintenir ses atomes d’hydrogène (ou ses substituants) sous cette forme, beaucoup d’énergie est nécessaire . Dans le cyclopropane tous les atomes d’hydrogène sont éclipsés. La différence d’énergie entre les formes éclipsées et décalées peut être importante comme nous le verrons pour les cycles de plus de trois atomes de carbone.
Cyclobutane:
La combustion du cyclobutane, dont les angles sont de 90° ~, produit un excès de 110.3 kJ/mol (27.6 kJ/mol / CH2) du à la tension de cycle. Il est inférieur à la flexion, car le cyclopropane forcé est plus petite que dans le cyclobutane dans le cyclopropane. La tension de ces deux cycles sont très importants. Pour de plus grands cycles, la tension diminue de manière significative et est à son minimum pour un cycle de 6 atomes de carbone, le cyclohexane.
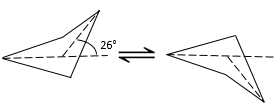
Les cycles avec plus de 3 atomes de carbone ne sont pas plan. Dans le cyclobutane l’angle entre le quatrième carbone de la molécule, en dehors du plan et le plan formé par les trois autres atomes de carbone est de 26°.
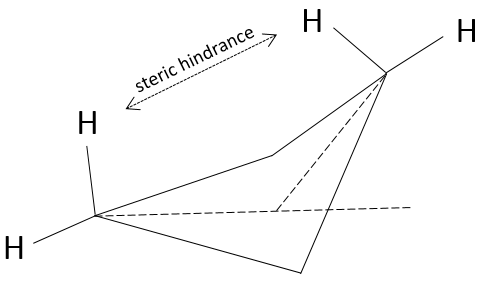
L’angle entre les atomes de carbone est 88,5° il est légèrement inférieur à un carré (90°) dans un seul plan. Alors, pourquoi le cyclobutane n’a pas une forme plane ? Il devrait en effet diminuer la tension du cycle. Toutefois dans la forme plane les 8 atomes d’hydrogène seraient éclipsés. Les 26° dans la structure du cyclobutane permettent que les atomes d’hydrogène puissent adopter la forme non éclipsée. La petite différence d’angle est ainsi compensée par l’amélioration du positionnement des atomes d’hydrogène. Il faut souligner que cette forme (avec 26 degré) peut exister sous 2 représentations spaciales et la structure du cyclobutane oscille entre les deux : l’atome de carbone en dehors du plan se déplace d’un côté du plan à l’autre, ces deux conformations sont équivalentes en énergie. En regardant la figure suivante, les 4 H sont représentés :
Deux d’entre eux (en remontant) sont assez proches les uns des autres tandis que les deux autres sont éloignés. Après l’oscillation les rôles sont inversés et les deux hydrogènes ont en moyenne le même encombrement stérique appelé également la tension trans-annulaire dans ce cas.
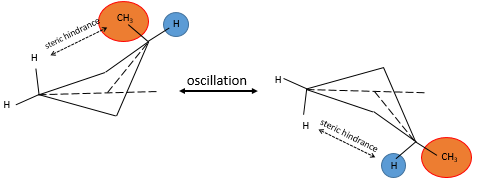
Les cycles peuvent ainsi osciller entre plusieurs conformations lorsque les conformations ont une énergie potentielle similaire et si la barrière énergétique entre différentes conformations est assez petite. Dans le cas de la cyclobutane l’encombrement est très faible mais si l’un de ces 4 hydrogènes était un substituant les deux conformères ne seraient plus équivalentes. En effet la molécule va se placer dans la conformation la plus favorable c.à.d la situation dans laquelle le substituant volumineux n’est pas affecté par la tension transannulaire. La proportion des conformères n’est plus 50:50.
Cyclopentane
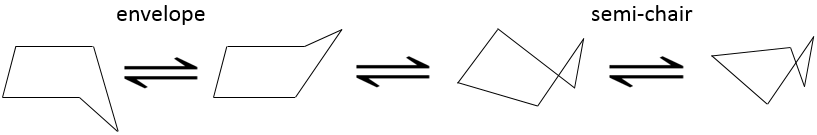
L’effet défavorable de l’hydrogène dans des conformations écliptiques est clair dans le pentane. Dans un pentagone régulier, l’angle est de 108°. C’est presque l’angle normal pour un carbone tétraédrique (109,5°). Cependant, les l’hydrogènes vont éclipser les uns les autres. En fait aucan cycloalcane à part le cyclopropane, n’ est plane. Deux conformations (chacune avec deux conformères) sont possibles : l’enveloppe et le semi-chaise.
Dans la conformation de l’enveloppe 4 atomes de carbone sont dans le même plan avec un angle de 104,4°. Dans l’autre conformation (semi-chaise), les angles sont plus petits mais l’effet éclipsant est aussi plus petit. Les deux conformations ont une énergie potentielle très proche et les barrières pour basculer entre les deux formes sont facilement franchies, le cyclopentane oscille alors rapidement entre ses conformères.
cyclohexane
Le cas du cyclohexane est particulier. Quand on regarde la chaleur de combustion de cette espèce la valeur expérimentale est inférieure de (0,8) kJ/ mol par rapport à celle calculée sur la base du nombre de CH2 dans la molécule, le cyclohexane est le cycloalcane le plus stable.
Deux conformations existent mais l’une est plus stable que l’autre.
La conformation la plus stable est la conformation chaise.
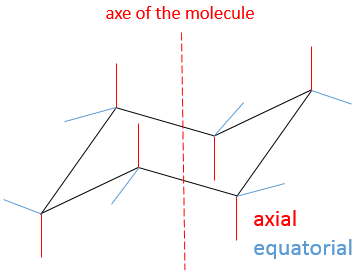
Dans cette conformation deux paires d’atomes de carbone sont dans le même plan et les deux derniers atomes de carbone sont de chaque côté du plan. Cette position est appelée chaise : les quatre atomes de carbone sur le plan font le siège, un plan de trois carbone rend le dos de la chaise et l’autre fait le repose-pied.
L’angle entre les carbones est de 111,4°, soit près de 109,5° d’un carbone tétraédrique normal et tous les atomes d’hydrogène sont dans une conformation en quinconce.
Cette structure est donc très stable. Deux types d’hydrogène peuvent être distingués : ceux de la position axiale et ceux de la position équatoriale. 6 liaisons CH sont parallèles à l’axe de la molécule (axe passant au milieu de la molécule) ce sont les hydrogènes axiales. Les 6 autres liaisons sont presque perpendiculaires et sont appelées équatoriales.
cyclohexane1
Si nous inversons la structure de la chaise (le dos de la chaise <-> le repose-pieds), les hydrogènes équatoriaux deviennent axiaux et vice versa.
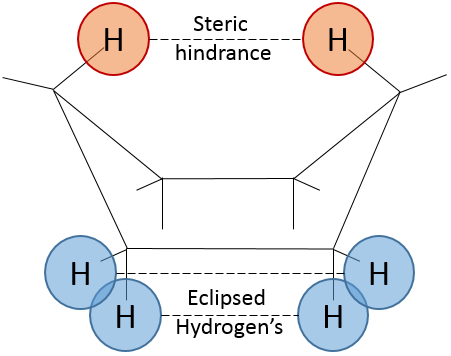
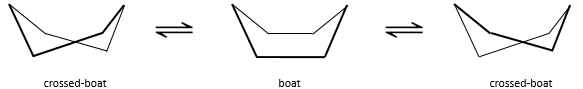
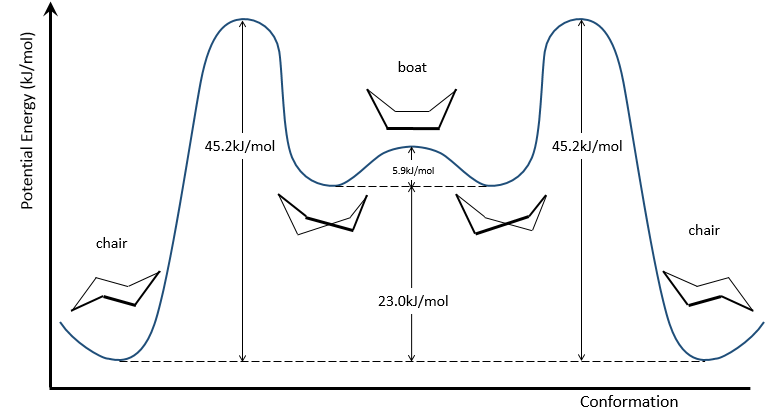
Pour inverser la chaise, le cyclohexane doit passer par la conformation de bateau, moins stable par 28.9kJ/mol (la barrière énergétique est de 45.2kJ/ mol). Dans cette conformation les deux atomes de carbone qui étaient hors du plan sont maintenant sur le même côté de celui-ci. Cela ne génère pas seulement un encombrement stérique mais les hydrogènes sur les quatre atomes de carbone, sur le plan, éclipsent les uns les autres. Ce qui explique la différence de l’énergie potentielle entre la forme de bateau et les formes de chaise.
En réalité cette conformation n’est qu’un état de transition. Une forme plus stable est la conformation de bateau-croisé, presque identique, mais avec la réduction de la tension transannulaire. La conformation bateau est donc l’état de transition entre les deux conformations bateau-croisés.
Nous pouvons résumer les conformations comme suit :
le cyclohexane dans les conformations de bateau n’existe que dans des proportions très faibles par rapport à la conformation chaise. Nous allons donc nous concentrer uniquement sur la conformation chaise pour nos autres analyses.
La présence de substituants sur le cyclohexane
Les positions d’un substituant sur le cyclohexane ne sont pas équivalentes :
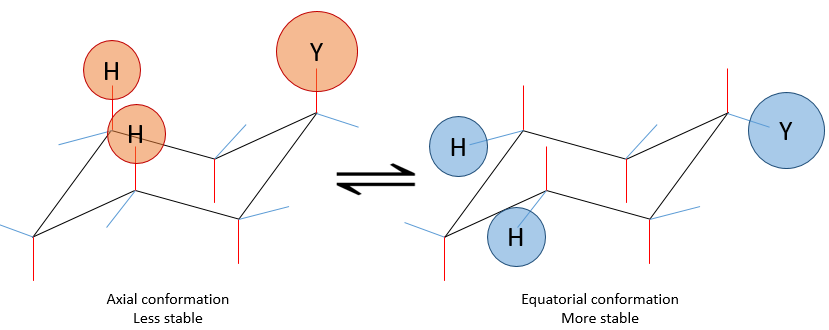
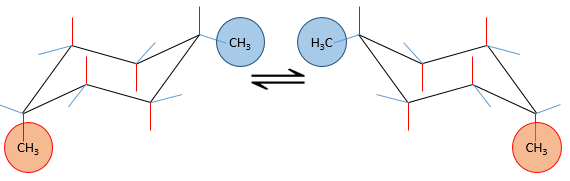
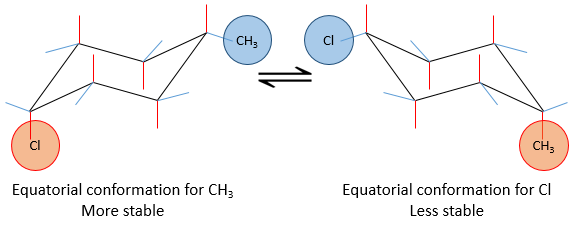
si un substituant est placé sur une position axiale l’encombrement stérique est supérieur à une position équatoriale. En effet, les substituants équatoriaux sont plus espacés que ceux axiaux qui vont dans la même direction. Ceci est appelé le 1,3-diaxial interaction. La position équatoriale pour un substituant est alors plus stable que celle axiale et une conformation de la molécule est favorisée. Par exemple, si le substituant est un groupe méthyle, la différence d’énergie entre les conformations est 7.1kJ/mol, ce qui conduit à une proportion de 95 : 5 (équatorial/axial). Les substituants plus volumineux entraînent une augmentation de la proportion de conformères.
La projection de Newman peut aider à visualiser ce phénomène. Dans le schemas ci-dessous les deux projections de NEWMAN sont représentées.
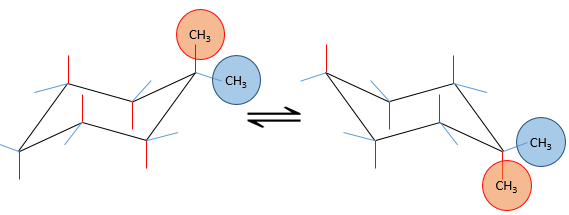
Plusieurs substituants peuvent être liés à un cyclohexane. L’influence sur la stabilité de chacun est, pour la plupart des substituants, un additif simple. Dans le cas de deux substituants on sera placé dans une position équatoriale de toute façon car il nécessite moins d’énergie que sur une position équatoriale (comme nous venons de le voir dans le cas d’un seul substituant). Ce substituant est le plus grand pour minimiser l’encombrement stérique. Le deuxième, plus petit, est sur une position axiale ou équatoriale, en fonction de la connectivité de la molécule. Si les deux groupes sont en positions équatoriales, l’équilibre est plus favorisé à l’égard de cette conformation. Si le second substituant est sur une position axiale, l’équilibre se déplace vers la composition 50:50, les effets des substituants agissent contre l’un de l’autre.
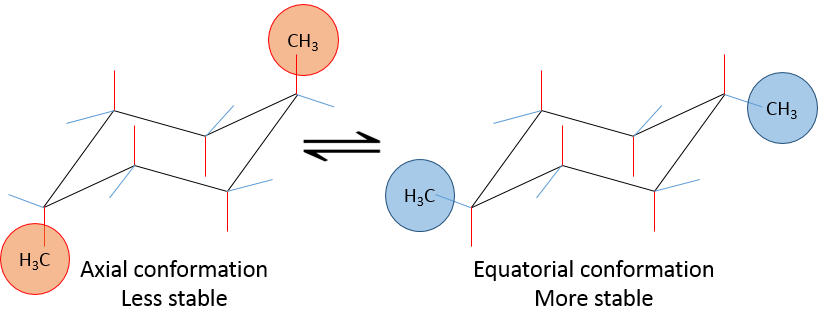
Voyons cela à travers quelques exemples. Comme expliqué précédemment la présence d’un méthyle sur le cyclohexane favorise la conformation équatoriale de 7,1 kJ/mol. La présence d’un deuxième groupe de méthyle sur un endroit équatorial va augmenter la proportion de la conformation équatoriale du même montant (7.1kJ/mol). L’avantage énergétique total de la conformation équatoriale atteint 14.2kJ/mole et la proportion des augmentations de conformères équatoriaux en outre vers 99: 1. Cette conformation est également notée trans parce que les groupes font en sens inverse. Le nom de cette molécule est en effet trans -1,4- diméthylcyclohexane.
Si le second groupe méthyle était sur une position axiale les deux conformères seraient équivalents (méthyle axial devient équatorial et vice versa). L’avantage énergétique totale de l’un des conformère est en effet 7.1kJ / mol-7.1kJ / mol = 0 kJ / mol.
Si le second groupe est un atome de chlore à la place d’un groupe méthyle, on procède de la même manière pour savoir quel conformère est favorisé. Un groupe de chlore seule stabilise la conformation équatoriale par 2.2kJ / mol. Si les deux substituants sont équatoriaux, l’avantage énergétique totale du conformère équatorial est 7.1kJ / mol (de CH3) + 2.2kJ mol (de Cl) = 9.3kJ / mol. Cette molécule est donc plus stable que le méthylcyclohexane.
Si l’atome de chlore était axial, l’avantage énergétique total du conformère dans lequel le groupe méthyle est équatorial est 7.1kJ/ mol-2.2kJ/mol = 4.9kJ/mol. Le conformère équatorial avec un groupe méthyle est encore plus stable que l’autre conformère mais moins que le méthylcyclohexane.
A noter que d’autres interactions peuvent affecter la stabilité des conformères. Lorsque les substituants sont sur d’autres points que 1-4, les interactions (comme l’encombrement stérique, répulsion, …) peuvent diminuer ou augmenter l’avantage énergétique d’un des conformères sur l’autre.
Alcanes polycycliques
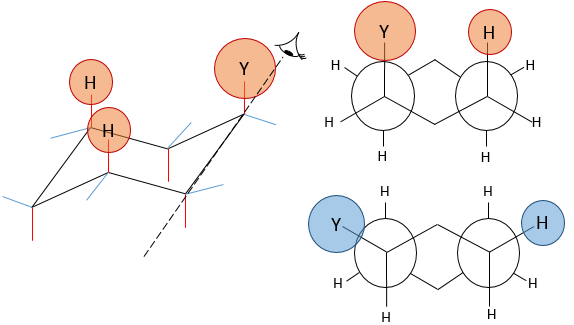
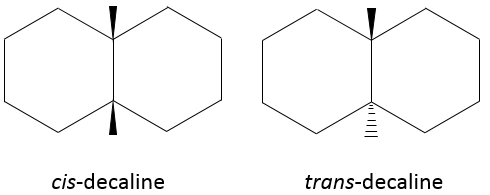
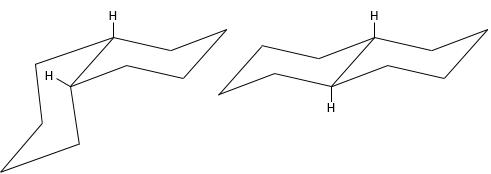
Les molécules ne sont pas limitées à un seul cycle. Plusieurs cycles peuvent partager les carbones. Une molécule composée de deux hexanes partageant deux atomes de carbone est appelé décaline et existe dans les formes trans et cis. Les cycles ne doivent pas nécessairement avoir la même taille et un cyclohexane peuvent fusionner avec un cyclopentane.
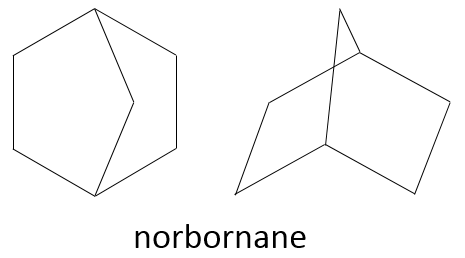
Deux cycles peuvent également être une fente dans l’autre. Cela conduit à des cycles pontés. Le Norborane est un cyclohexane ponté où 2 cyclopentanes partagent 3 atomes de carbone . Les carbones portant le pont sont appelés tête de pont.
Les alcanes polycycliques réduisent la liberté de mouvement de la molécule mais il semble qu’il n’y a pas de limite à la tension de cycle que les hydrocarbures peuvent supporter comme on peut le penser de la cyclobutane.
Les polycycliques avec des cycles de quelques atomes de carbone (3-4) ne sont en général pas produit naturellement mais peuvent être synthétisées. Tous les types de squelettes de carbone ont été réalisés au laboratoire. Ils peuvent avoir un intérêt comme explosifs s’ ils portent des groupes nitro grâce à leur tension de cycle importante .
Les polycycles de grands cycles sont souvent trouvés dans les composés naturels donnant des odeurs spécifiques, parfums, couleurs, ou des rôles très spécifiques comme hormones.
cet article a été traduit de l’anglais (cf borzuya en anglais)