Ces vectors de clonage ont été développés dans les années 80 et leur utilisation a conduit à la culture des OGM (organismes génétiquement modifiées). Trois types de vecteurs ont été utilisés avec plus ou moins de succès pour le clonage des Plantes :
- Vecteurs à base de plasmides naturels d’Agrobacterium.
- Transfert direct de gène en utilisant différents types d’ADN plasmidique.
-
Vecteurs à base de virus végétaux.
Agrobacterium tumefaciens – le plus petit ingénieur génétique de la nature :
Bien qu’aucun plasmide naturel ne soit connu dans les plantes supérieures, un plasmide bactérien, le plasmide Ti d’Agrobacterium tumefaciens, est d’une grande importance. A. tumefaciens est un micro organisme du sol qui cause la maladie de la galle du collet chez de nombreuses espèces de plantes dicotylédones. La gale de la couronne se produit lorsqu’une plaie sur la tige permet à la bactérie A.Tumefaciens d’envahir la plante. Après l’infection, les bactéries provoquent une prolifération du tissu de la tige dans la région de la couronne. La capacité de causer la maladie de la galle de la couronne est associée à la présence du plasmide Ti (tumeur Induisant) dans la cellule bactérienne. Il s’agit d’un grand plasmide (plus de 200 kb) qui porte de nombreux gènes impliqués dans le processus infectieux. Une caractéristique remarquable du plasmide Ti est que, après infection, une partie de la molécule est intégrée dans l’ADN chromosomique de la plante . Ce segment, appelé T-ADN, est entre 15 et 30 kb, selon la souche. Il est maintenu sous une forme stable dans la cellule végétale et est transmise à des cellules filles en tant que partie intégrante des chromosomes.
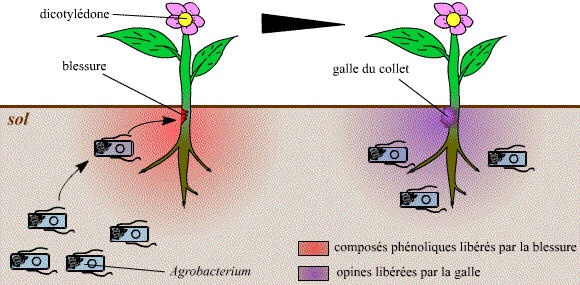
Mais la caractéristique la plus remarquable du plasmide Ti est que l’ADN-T contient Huit gènes qui sont exprimés dans la cellule végétale et sont responsables des Propriétés cancereuses des cellules transformées. Ces gènes dirigent également la synthèse de Composés, appelés opines, que les bactéries utilisent comme nutriments. En bref, A. tumefaciens modifie génétiquement la cellule végétale pour ses propres fins.
Utilisation du plasmide Ti pour introduire de nouveaux gènes dans une cellule végétale :
Il a été réalisé très rapidement que le plasmide Ti pouvait être utilisé pour transporter de nouveaux gènes dans des cellules végétales. Tout ce qui serait nécessaire serait d’insérer les nouveaux gènes dans l’ADN-T et ensuite la bactérie pourrait faire le travail acharné pour les intégrer dans l’ADN chromosomique de la plante. En pratique, cela s’est avéré une proposition délicate, principalement parce que la grande taille du plasmide Ti rend la manipulation de la molécule très difficile. Le problème principal est, bien entendu, qu’un site de restriction unique est impossible avec un plasmide de 200 kb. De nouvelles stratégies doivent être développées pour l’insertion d’un nouvel ADN dans le plasmide. Les deux techniques suivantes sont actuellement utilisées :
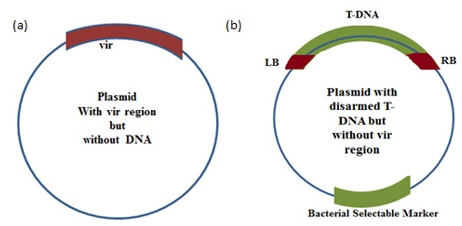
La stratégie du vecteur binaire :
elle est basée sur l’observation que le L’ADN-T n’a pas besoin d’être physiquement fixé au reste du plasmide Ti. Un système à deux plasmides, avec l’ADN-T sur une molécule relativement petite, et le reste sur un plasmide sous sa forme normale, est tout aussi efficace à la transformation des cellules végétales. En fait, certaines souches de A. tumefaciens et les autres agro-bactéries de la famille ont normalement des systèmes plasmidiques binaires. Le plasmide T-ADN est suffisamment petit pour avoir un seul site de restriction et d’être manipulé en utilisant des techniques standards.
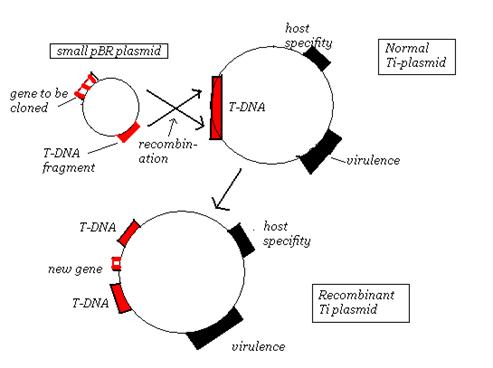
La stratégie de co-intégration:
celle-ci utilise un plasmide entièrement nouveau, basée sur un vecteur d’E. coli, mais portant une petite partie de l’ADN-T. L’homologie entre la nouvelle molécule et le plasmide Ti signifie que si les deux sont présents dans la même cellule d’ A. tumefaciens, la recombinaison peut intégrer le plasmide E. coli dans La région T-ADN. Le gène à cloner est donc inséré dans un site de restriction sur le petit plasmide E. coli, introduit dans des cellules de A. tumefaciens Portant un plasmide Ti, et le processus de recombinaison naturelle fait le nécessaire pour intégrer le nouveau gène dans l’ADN-T. L’infection de la plante conduit à l’insertion du nouveau gène, avec le reste de l’ADN-T, dans les chromosomes végétaux.
Production de plantes transformées avec le plasmide Ti:
Si des A. tumefaciens contenant un plasmide Ti modifié sont introduites dans une plante d’une manière naturelle, par l’infection d’une plaie dans la tige, alors seules les cellules de la galle de la couronne résultante posséderont le gène cloné. Cela évidemment est de faible valeur pour le biotechnologiste. Au lieu de ça, l’introduction du nouveau gène dans chaque cellule de la plante est nécessaire. Il existe plusieurs solutions, la plus simple étant d’infecter non pas la plante mature mais plutôt la culture de cellules végétales ou de protoplastes en milieu liquide. Les cellules végétales et les protoplastes dont les parois cellulaires se sont formés peuvent être traités de la même manière que les micro-organismes: par exemple, ils peuvent être cultivées sur un milieu sélectif pour isoler les transformants. Une plante mature régénérée à partir de cellules transformées contiendra le gène cloné dans chaque cellule et passera le gène cloné à sa progéniture. cependant, La régénération d’une plante transformée ne peut se produire que si le vecteur Ti a été « désarmé » De sorte que les cellules transformées ne présentent pas de propriétés cancéreuses. Le désarmement est possible Parce que les gènes du cancer, qui sont tous dans l’ADN-T, ne sont pas nécessaires pour l’infection , L’infectiosité étant contrôlée principalement par la région de virulence du Ti plasmide. En fait, les seules parties de l’ADN-T qui sont impliquées dans l’infection sont deux séquences de répétitions de 25 pb trouvées aux frontières gauche et droite de la région L’ADN de la plante. Tout ADN placé entre ces deux séquences répétées sera traité comme « T-ADN » et transféré à la plante. Il est donc possible d’éliminer tous les gènes de cancers de l’ADN-T normal, et de les remplacer par un ensemble entièrement nouveau de gènes, Sans perturber le processus d’infection. Un certain nombre de vecteurs de clonage Ti désarmés sont maintenant disponibles, un exemple typique étant Le vecteur binaire pBIN19.
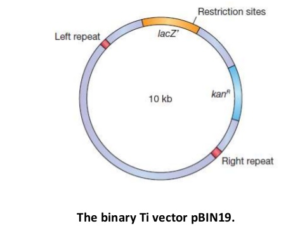
Les frontières de T-ADN gauche et droite Ce vecteur flanque une copie du gène lacZ ‘, contenant un certain nombre de sites de clonage, et un Gène de résistance à la kanamycine qui fonctionne après l’intégration des séquences Le chromosome végétal. Comme avec un vecteur navette de levure, les manipulations initialesQui entraînent l’insertion du gène à cloner dans pBIN19 sont réalisées dans E. coli, La molécule recombinante pBIN19 recombinante étant alors transférée à A. tumefaciens et De là dans la plante. Les cellules végétales transformées sont sélectionnées par étalement sur un milieu gélose Contenant de la kanamycine.
Le plasmide Ri :
Au fil des ans, il y a eu également un intérêt à développer des vecteurs de clonage basés sur le plasmide Ri d’Agrobacterium rhizogenes. Les plasmides Ri et Ti sont très semblables et la principale différence étant que le transfert de l’ADN-T d’un plasmide Ri à une plante a pour résultat non pas une galle de la couronne mais plutot la maladie des racines poilues, caractérisées par une racine très ramifiée. La possibilité de cultiver des racines transformées dans une culture liquide à haute densité a été exploré comme un moyen potentiel de produire des grandes quantités de protéines à partir de gènes clonés dans ces plantes.
Les limites du clonage avec des plasmides d’Agrobacterium :
Les plantes supérieures sont divisées en deux grandes catégories, les monocotylédones et les dicotylédones. Plusieurs facteurs se sont combinés pour rendre beaucoup plus facile le clonage de gènes chez les dicotylédones (la tomate, le tabac, la pomme de terre, les pois et les haricots) mais beaucoup plus difficile d’obtenir les mêmes résultats avec les monocotylédones. Cela a été frustrant parce les monocotylédones comprennent le (blé, L’orge, le riz et le maïs), qui sont les plantes de culture les plus importantes et donc les Cibles souhaitables pour les projets d’ingénierie génétique. La principale difficulté vient du fait que dans la nature l’A. tumefaciens et A. rhizogenes Infectent uniquement les plantes dicotylédones; Les monocotylédones sont en dehors de la gamme normale d’hôtes. Pendant quelque temps, on a pensé que cette barrière naturelle était insurmontable et que les Monocotylédones étaient totalement résistantes à la transformation avec des vecteurs Ti et Ri, mais finalement Des techniques artificielles pour réaliser le transfert d’ADN-T ont été imaginées. La transformation avec un vecteur d’Agrobacterium normalement Implique la régénération d’une plante intacte à partir d’un protoplaste, d’une cellule ou d’un calus transformés en Culture. La facilité avec laquelle une plante peut être régénérée dépend beaucoup des espèces particulières concernées et, encore une fois, les plantes les plus difficiles sont les monocotylédones. Les tentatives pour contourner ce problème se sont concentrées sur l’utilisation de bombardement biologique avec des microprojectiles pour introduire directement l’ADN plasmidique dans les embryons végétaux. Bien qu’il s’agisse d’une procédure de transformation assez violente, semblant trop dommageable pour les embryons, en réalité ces derniers continuent leur développement normal Pour produire des plantes matures. L’approche a été couronnée de succès avec le maïs Et plusieurs autres monocotylédones importantes.
Transfert direct de gènes:
Transfert direct de gènes dans le noyau:
Le transfert direct de gènes est basé sur l’observation, d’abord faite en 1984, qu’un plasmide bactérien super-enroulé, bien qu’il ne soit pas capable de se reproduire seul dans une cellule végétale, puisse être intégré par recombinaison dans l’un des chromosomes végétaux. L’événement de recombinaison est mal compris mais est presque certainement distinct des processus responsables de l’intégration d’ADN-T. Elle est également distincte de l’intégration chromosomique d’un vecteur de levure, car il n’existe aucune exigence pour une région de similarité entre le plasmide bactérien et l’ADN végétal. En fait, l’intégration semble se produire de façon aléatoire à n’importe quelle position dans n’importe lequel des chromosomes végétaux. Le transfert direct de gène utilise donc un ADN de plasmide super-enroulé, éventuellement un plasmide bactérien simple, dans lequel un marqueur sélectionnable approprié (par exemple, un gène de résistance à kanamycine) et le gène à cloner ont été insérés. La biolistique est fréquemment utilisée pour introduire l’ADN plasmidique dans des embryons végétaux, mais si l’espèce à cloner Peut être régénérée à partir de protoplastes ou des cellules uniques, alors d’autres stratégies, éventuellement plus efficaces que la biolistique, sont possibles. Un procédé consiste à remettre en suspension des protoplastes dans une solution visqueuse de polyéthylèneglycol, un composé polymère chargé négativement qui est censé précipiter l’ADN sur les surfaces des protoplastes et induire une absorption par endocytose (figure 7.16).

L’électroporation est également utilisée pour augmenter la fréquence de transformation. Après traitement, les protoplastes sont laissés pendant quelques jours dans une solution qui favorise la régénération des parois cellulaires. Les cellules sont ensuite étalées sur un milieu sélectif pour identifier les transformants et pour fournir des cultures de cals à partir desquelles des plantes intactes peuvent être cultivées (exactement comme décrit pour le système d’Agrobacterium).
Transfert de gènes dans le génome des chloroplastes :
Si la biolistique est utilisée pour introduire l’ADN dans un embryon végétal, certaines particules peuvent pénétrer un ou plusieurs des chloroplastes présents dans les cellules. Les chloroplastes contiennent leur propre génome, distinct et beaucoup plus court que les molécules d’ADN du noyau, et dans certaines circonstances, l’ADN plasmidique peut s’intégrer dans ce génome du chloroplaste. Contrairement à l’intégration de l’ADN dans les chromosomes nucléaires, l’intégration dans le génome des chloroplastes ne se produira pas de façon aléatoire. Au lieu de cela, l’ADN à cloner doit être flanqué de séquences similaires à la région du génome du chloroplaste dans laquelle l’ADN doit être inséré, de sorte que l’insertion peut avoir lieu par recombinaison homologue.
Chacune de ces séquences flanquantes doit avoir une longueur d’environ 500 pb. Un faible niveau de transformation du chloroplaste peut également être obtenu après l’administration d’ADN induite par PEG dans des protoplastes si le plasmide qui est prélevé porte ces séquences flanquantes. Une cellule végétale contient des dizaines de chloroplastes, et probablement seulement une par cellule devient transformée, de sorte que l’ADN inséré doit porter un marqueur sélectionnable tel que le gène de résistance à la kanamycine, et les embryons doivent être traités avec l’antibiotique pendant une période considérable pour s’assurer que Les génomes transformés se propagent dans la cellule. Bien que cela signifie que la transformation des chloroplastes est une méthode difficile à mettre en œuvre avec succès, elle pourrait devenir un adjuvant important aux méthodes plus traditionnelles pour obtenir des cultures OGM. Comme chaque cellule possède de nombreux chloroplastes, mais seulement un noyau, un gène inséré dans le génome du chloroplaste est susceptible d’être exprimé à un niveau supérieur à celui placé dans le noyau. Ceci est particulièrement important lorsque les plantes modifiées doivent être utilisées pour la production de protéines pharmaceutiques. Jusqu’à présent, l’approche a été la plus réussie avec le tabac, mais la transformation des chloroplastes a également été réalisée avec des cultures plus utiles comme le soja et le coton.
Utilissation des virus végétaux comme vecteurs de clonage :
Les versions modifiées des bactériophages λ et M13 sont des vecteurs de clonage importants pour E. coli. La plupart des plantes sont sujettes à une infection virale, est ce que les virus pourraient être utilisés pour cloner les gènes dans les plantes? Si elles le pouvaient, elles seraient beaucoup plus pratiques à utiliser que d’autres types de vecteurs, car avec de nombreux virus la transformation peut être obtenue simplement en frottant l’ADN du virus sur la surface d’une feuille. Le processus d’infection naturelle répand ensuite le virus dans toute la plante. Le potentiel des virus végétaux comme vecteurs de clonage a été exploré pendant plusieurs années, mais sans grand succès. Un problème est que la grande majorité des virus végétaux ont des génomes non d’ADN mais d’ARN. Les virus à ARN ne sont pas aussi utiles que les vecteurs de clonage potentiels car les manipulations avec l’ARN sont plus difficiles à réaliser. Seules deux classes de virus à ADN sont connues pour infecter des plantes supérieures, les caulimovirus et les geminivirus, et aucune d’entre elles n’est idéalement adaptée au clonage de gènes.
Les vecteurs à Caulimovirus :
Bien que l’une des premières expériences réussies d’ingénierie génétique végétale, en 1984, a utilisé un vecteur de caulimovirus pour cloner un nouveau gène dans des plantes de navet, deux difficultés générales avec ces virus ont limité leur utilité. La première est que la taille totale d’un génome de caulimovirus est, comme celle de e, contrainte par la nécessité de l’emballer dans sa couche de protéine. Même après la suppression de sections non essentielles du génome viral, la capacité de transporter l’ADN inséré est encore très limitée. Des recherches récentes ont montré qu’il serait possible de contourner ce problème en adoptant une stratégie de virus auxiliaire, semblable à celle utilisée avec les phagemides . Dans cette stratégie, le vecteur de clonage est un génome du virus de la mosaïque du chou-fleur (CaMV) qui manque de plusieurs des gènes essentiels, ce qui signifie qu’il peut transporter un gros segment d’ADN mais ne peut pas par lui-même causer une infection directe. Les plantes sont inoculées avec l’ADN vecteur avec un génome CaMV normal. Le génome viral normal fournit les gènes nécessaires pour que le vecteur de clonage soit emballé dans des protéines virales et se propage à travers la plante. Cette approche a un potentiel considérable, mais ne résout pas le deuxième problème, qui est la gamme extrêmement étroite de l’hôte de caulimovirus. Cela limite les expériences de clonage à quelques plantes seulement, principalement des champignons tels que les navets, les choux et les choux-fleurs. Les caulimovirus ont toutefois joué un rôle important dans le génie génétique comme source de promoteurs très actifs qui fonctionnent dans toutes les plantes et qui sont utilisés pour obtenir l’expression de gènes introduits par clonage de plasmide Ti ou transfert de gène direct.
Les vecteurs à Geminivirus:
Ceux-ci sont particulièrement intéressants parce que leurs hôtes naturels comprennent des plantes telles que le maïs et le blé, et ils pourraient donc être des vecteurs potentiels pour ces monocotylédones et d’autres. Mais les geminivirus ont présenté leur propre série de difficultés, un problème étant que pendant le cycle d’infection, les génomes de certains geminivirus subissent des réarrangements et des déletions, ce qui entraînerait un quelconque ADN supplémentaire qui a été inséré, un désavantage évident pour un vecteur de clonage. La recherche au fil des ans a abordé ces problèmes, et les geminivirus commencent à trouver des applications spécialisées dans le clonage de gènes de plantes. L’un d’entre eux est le séquençage génique induit par virus (VIGS), une technique utilisée pour étudier les fonctions des gènes de plantes individuelles. Cette méthode exploite l’un des mécanismes de défense naturelle que les plantes utilisent pour se protéger contre les attaques virales. Cette méthode, appelée ARN silencieux, entraîne une dégradation des ARNm viraux. Si l’un des ARN viraux est transcrit à partir d’un gène cloné contenu dans un génome de geminivirus, alors non seulement les transcrits viraux mais aussi les ARNm cellulaires dérivés de la copie du gène de la plante sont dégradés (figure 7.17). Le gène végétal devient donc silencieux et l’effet de son inactivation sur le phénotype de la plante peut être étudié.