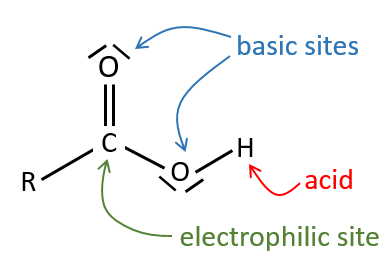
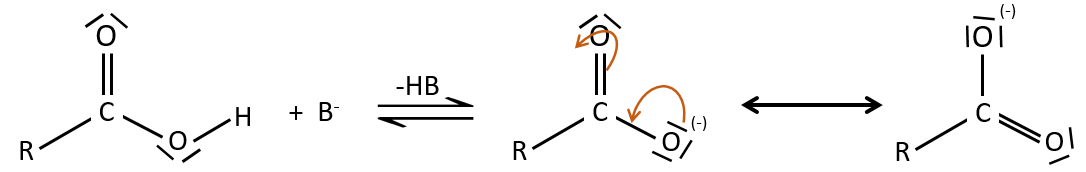
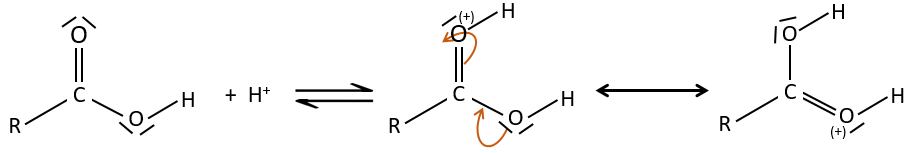
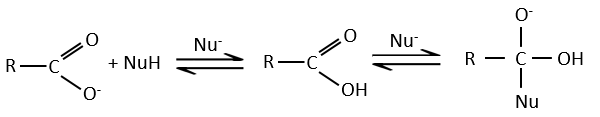
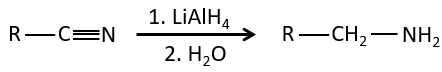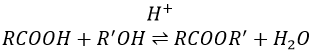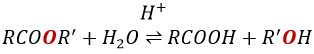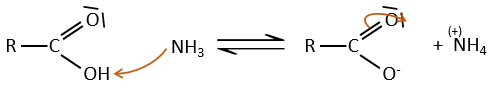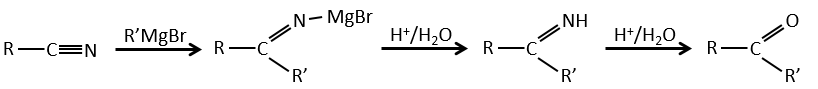Tous les atomes de groupes acides carboxyliques ont un caractère spécifique. Le groupe est donc ambident: il possède deux ou plusieurs centres réactifs distinguables, alternatifs et en forte interaction. Il a des propriétés acides et basiques.
All the atoms of carboxylic acids groups have a specific character. The group is thus ambident: it possesses two or more alternative and strongly interacting distinguishable reactive centres. It has acidic and basic properties.
Un acide carboxylique est plus acide que l’alcool correspondant car la base conjugué le carboxylate, est stabilisée par résonance (pKa≈5 vs pKa≈17).
L’oxygène du carbonyle est plus basique que l’autre parce que la charge positive est plus stabilisée.
Synthèse d’acides carboxyliques :
Il existe plusieurs façons pour former des acides carboxyliques :
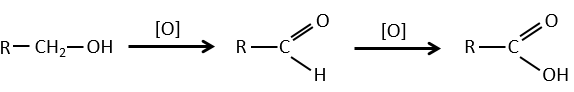
1) par oxydation :
Les acides carboxyliques peuvent être faits par l’oxydation d’aldéhydes ou d’alcools. Nous pouvons utiliser CrO3 ou KMnO4 comme oxydants par exemple.
2) par Grignard :
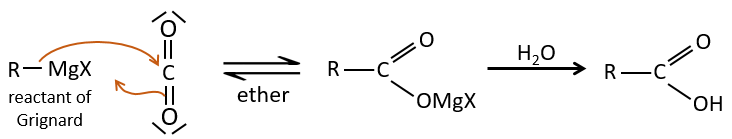
Une réaction de Grignard peut réagir avec du CO2, puis avec de l’eau pour former un acide carboxylique
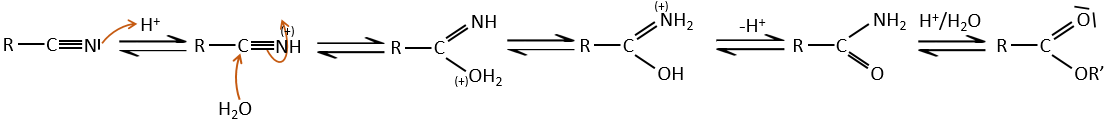
3) à partir de nitriles :

Dans les environnements acides les nitriles réagissent avec l’eau pour générer de nouveaux acides et libérer une molécule d’ammoniac.

Cette méthode peut être utilisée pour étendre une chaîne carbonique. Une fois qu’un acide carboxylique est obtenu on le réduit pour obtenir un alcool. Le groupe -OH est éliminé par substitution nucléophile et la boucle redémarre. Chaque boucle ajoute un carbone dans la chaîne.
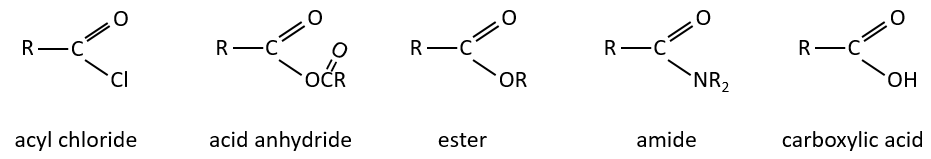
Les dérivés d’acides carboxyliques sont :
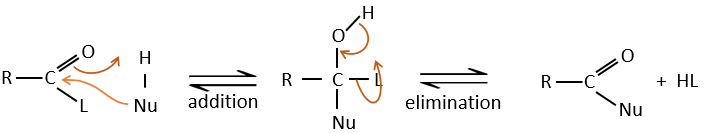
Réaction d’addition-élimination :
Les acides carboxyliques et leurs dérivés sont attaqués par des nucléophiles sur le carbone, comme cela est fait pour les cétones et les aldéhydes. Toutefois cet ajout est suivi par une élimination.
C’est ainsi la substitution d’un groupe par le nucléophile à la condition que le groupe L qui était auparavant sur le carbonyle soit un groupe partant meilleur que le nucléophile.
Cl–>RCOO–>RO–>OH–>NR2–>C–
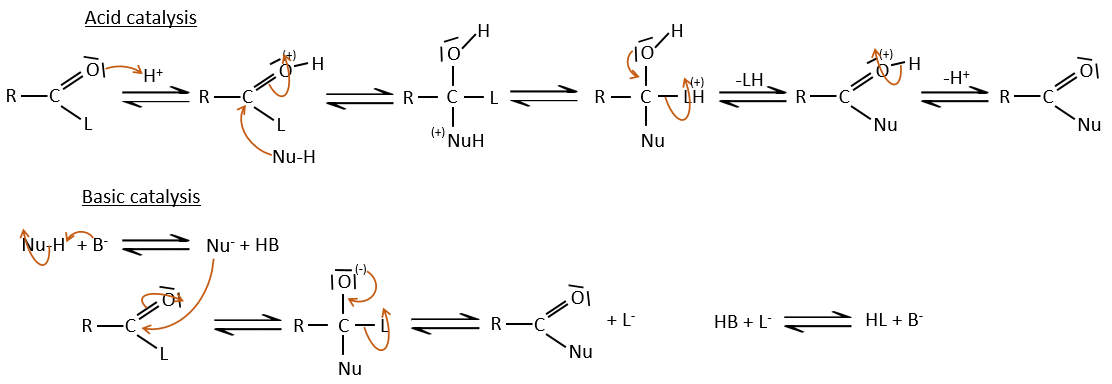
Comme pour les aldéhydes et les cétones la réaction peut être catalysée par un acide ou une base.
A noter que la réaction d’addition-élimination pour les acides carboxyliques est en concurrence avec les réactions acide-base. Le OH– n’est pas un très bon groupe partant et si le nucléophile est une base forte il y aura la formation de carboxylate. Dans le cas d’un nucléophile qui ne soit pas une base forte il y aura une concurrence entre les réactions AE et AB.
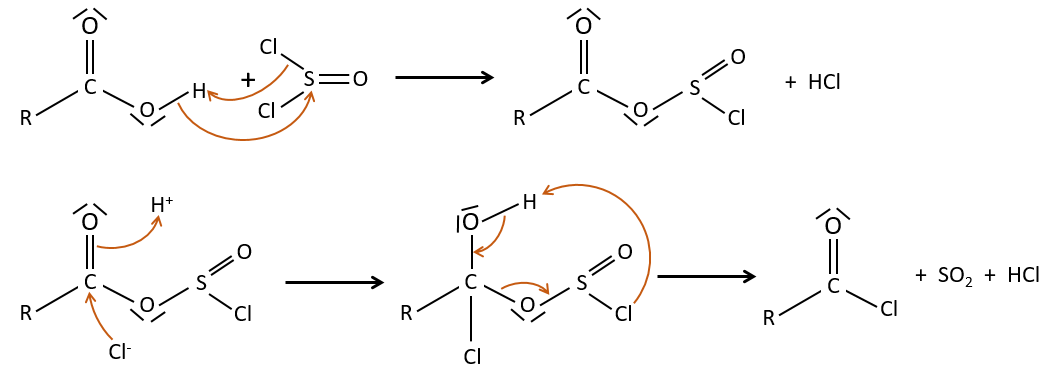
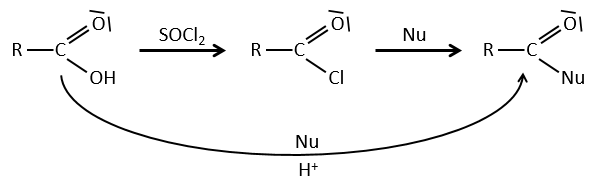
La formation du chlorure d’acyle :
D’après ce que nous avons écrit juste au-dessus nous ne pouvons pas remplacer RCOOH par RCOCl parce Cl– qui est un groupe partant meilleur que OH–. Cependant il y a un truc pour que cette réaction soit possible : nous utilisons du chlorure de thionyle (SOCl2). L’oxygène lié à l’hydrogène dans un groupe COOH est un nucléophile et peut attaquer l’atome de soufre en expulsant un atome de chlore qui attire le proton sur son chemin. L’acide chlorhydrique nouvellement formé peut maintenant réagir avec le thioester, éliminant une molécule de SO2 et de HCl.
Le même genre de mécanisme est utilisé pour produire de l’acide bromique à partir des acides carboxyliques et PBr3 (de tribromure de phosphore). Pourtant ces réactions ne fonctionnent pas avec HCOOH parce que les produits HCOCl et HCOBr sont instables. Ils se décomposent en monoxyde de carbone et l’acide correspondant.
La formation d’esters :
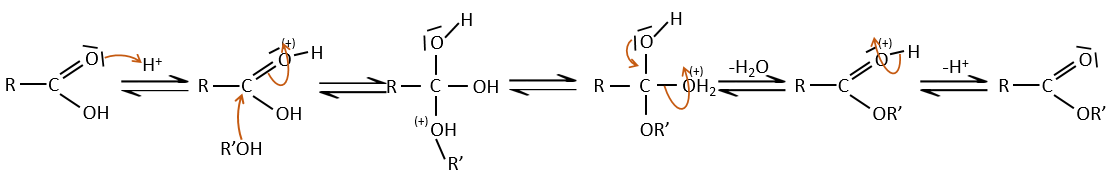
Les acides carboxyliques réagissent avec des alcools pour produire des esters.
Les acides forts catalysent cette réaction.
RO est un groupe partant légèrement meilleur que OH- si l’on veut déplacer l’équilibre vers la droite on le fait par l’utilisation d’un excès d’alcool ou d’acide carboxylique et par l’élimination de l’eau du système. Si nous voulons faire de l’hydrolyse d’un ester à savoir la réaction inverse, nous utilisons un excès d’eau. Il a été montré que l’hydrolyse des esters fonctionne de cette façon (attaque de l’eau sur le groupe carbonyle et pas d’attaque de l’eau sur R’) par l’utilisation d’isotopes de l’oxygène esterique.
Une autre façon d’obtenir des esters est l’utilisation de diazométhane, la réaction que nous avons vu au début du chapitre de l’élimination.
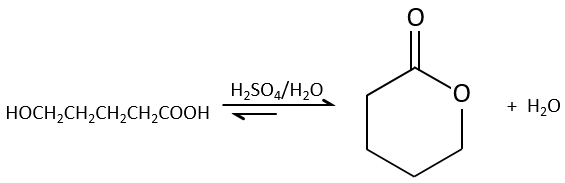
Des estérifications intramoléculaires sont plus favorables que les intermoléculaires pour des raisons entropiques et sont particulièrement favorables si un cycle de 5 ou 6 atomes se forme.
Ce type de cycle est appelé une lactone (δ-lactone si c’est un cycle de 6 atomes de carbone, γ-lactone si c’est un cycle de 5, etc.). Les lactones sont sensibles à l’hydrolyse.
Formation d’amides :
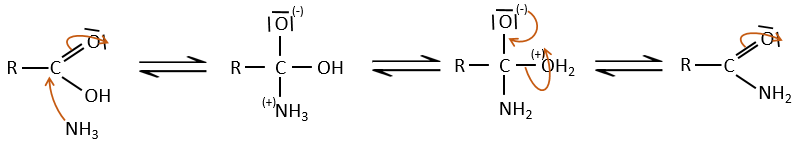
Dans des conditions normales une amine réagit avec un acide carboxylique pour former un sel (carboxylate d’ammonium) par une réaction acido-basique. Une fois que l’amine a pris le proton elle ne peut plus attaquer le groupe carbonyle.
Si l’on chauffe le système, la réaction va plus en arrière et un autre processus, thermodynamiquement plus favorable se produit, conduisant à la formation d’un amide. Dans un amide l’atome d’azote est non basique.
Les réactions intramoléculaires sont possibles et conduisent à la formation de lactames.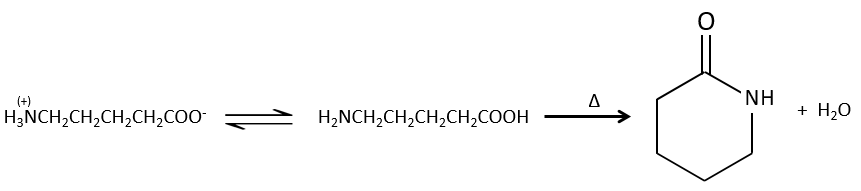
Les réactions d’acides carboxyliques et leurs dérivés :
Nous avons montré plusieurs réactions des acides carboxyliques. Il est souvent intéressant d’envisager de transformer l’acide carboxylique en un chlorure d’acyle avant la réaction souhaitée. Les chlorures d’acyle sont habituellement plus réactifs et cette étape supplémentaire dans le procédé peut augmenter le rendement global de la réaction.
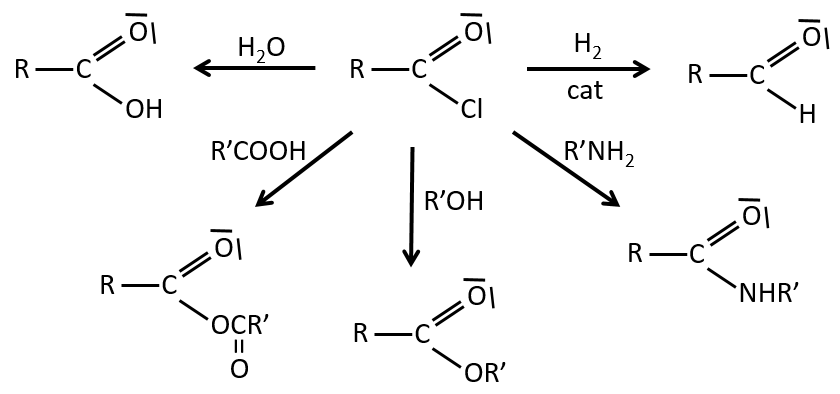
Les réactions des chlorures d’acyle :
Du chlorure d’acyle on peut obtenir beaucoup d’autres groupes fonctionnels.
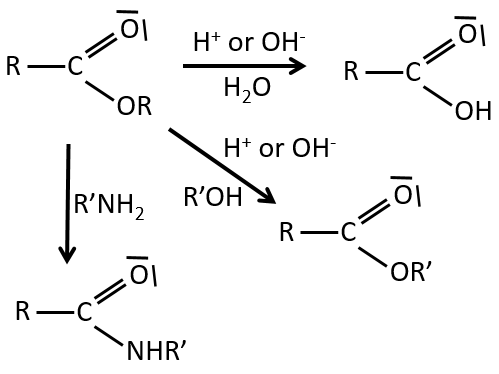
Les réactions d’esters :
Comme les esters sont moins réactifs que les chlorures d’acyle, moins de réactions sont disponibles. On peut hydrolyser l’ester, échanger la chaîne estérique avec une autre chaine estérique ou générer un amide.
Une réaction supplémentaire consiste à utiliser un réactif de Grignard sur un ester pour obtenir un alcool tertiaire. La cétone est plus réactive que l’ester de sorte que la réaction se poursuit.
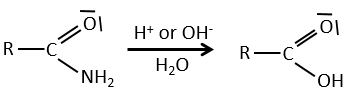
Les réactions des amides :
Les liaisons peptidiques peuvent être hydrolysées.
Réactions des nitriles :
L’atome de carbone à partir d’un nitrile est dans le même état d’oxydation que celui de l’acide carboxylique. Un nitrile en présence d’eau et d’acide conduit à la formation d’un acide carboxylique et le rejet de l’ammoniac.
Les nitriles peuvent également réagir avec des réactifs de Grignard mais la réaction s’arrête à la formation de cétones.
Les nitriles peuvent également être réduits en amines primaires par LiAlH4.