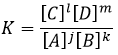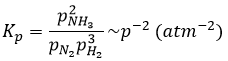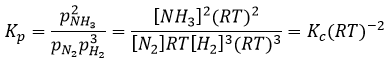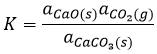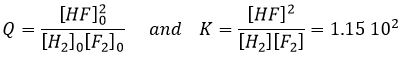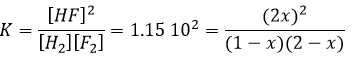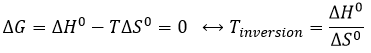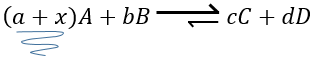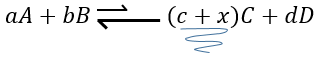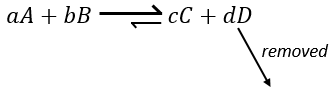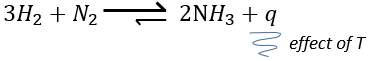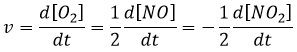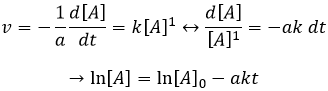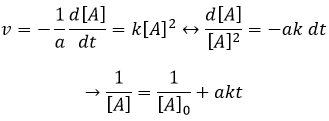La cinétique chimique est l’étude de la vitesse des réactions. La vitesse de réaction est déterminée par la variation de la quantité d’espèces par unité de temps. Habituellement nous considérons les concentrations pour les espèces en solution et nous considérons les pressions pour les gaz.
La vitesse d’une réaction est rarement constante et positive jusqu’à ce que le système atteigne l’équilibre. A l’équilibre la vitesse de réaction est égale à zéro.
L’ équilibre :
imaginons la réaction suivante :
L’équilibre est atteint lorsque les concentrations des espèces ne varient plus dans le temps. La constante d’équilibre, qui exprime la loi d’action de masse, est :
La constante de la réaction inverse (de droite à gauche) est K ‘= 1 / K et si l’on considère un multiple n de cette réaction on aura :
K »= Kn parce que les coefficients stoechiométriques sont les exposants de l’expression de la constante d’équilibre.
Les unités de K dépendent de la réaction. Par exemple la réaction de Haber qui génère de l’ammoniac et que nous avons déjà rencontré avant :
a une constante d’équilibre Kp qui dépend de la pression des réactifs et des produits.
Les unités de K dépendent donc de la quantité des différents produits et réactifs et de leurs coefficients stoechiométriques. Nous notons la constante avec un P parce que nous considérons habituellement les constantes d’équilibre en terme de concentrations que nous pouvons désigner Kc. Il y a une relation entre Kc et Kp que nous trouvons avec la loi des gaz parfaits PV = nRT
La relation entre la pression et la concentration est ainsi simplement une multiplication par RT. Dans l’expression de K ce RT est également à la puissance du coefficient stoechiométrique.
Pour la réaction de Haber nous trouvons :
Dans le cas des phases condensées nous ne tiendrons pas compte de la concentration ni de la pression parce que les interactions entre les espèces doivent être prises en compte. Nous considérerons l’activité des espèces à la place de ces paramètres. L’activité est proportionnelle à la concentration d’une espèce ou à sa pression multipliée par un coefficient γ. L’équilibre peut être hétérogène si toutes les espèces qui interviennent dans la réaction ne sont pas de la même phase. Dans ce cas aussi nous considérerons les activités de l’espèce à la place de leur concentration ou de leur pression. Par exemple la réaction :
est une réaction où deux solides et un gaz coexistent. Il a la constante d’équilibre suivante :
Nous choisissons volontairement une réaction impliquant des solides parce que leur activité est égale à 1. La constante est donc tout simplement proportionnelle à la pression de CO2. Dans un système fermé la réaction n’aura pas lieu même si nous augmentons la quantité de réactif. La réaction est seulement limitée par la pression du gaz.
Pour déterminer le sens d’une réaction nous comparons la constante d’équilibre K avec le coefficient réactif Q. Le Q est déterminé à partir des concentrations initiales mises en présence.
Pour la réaction :
le coefficient Q et la constante d’équilibre K sont respectivement
Si l’on considère un système de 5l contenant les quantités suivantes de chaque espèce :
Étant donné qu’il n’y a pas de produit dans cette composition la réaction ira évidemment de la gauche vers la droite. Il est impossible d’obtenir des concentrations négatives. La réaction va se poursuivre jusqu’à ce qu’elle atteigne l’équilibre ou que la totalité de l’un des réactifs soit consommée. On peut déterminer la concentration de chaque espèce à l’équilibre avec le procédé suivant :
Nous déterminons les concentrations des espèces. Ici nous avons donné le volume du récipient et le nombre de moles de chaque espèce. Nous les écrivons dans un tableau et supposons qu’une concentration x sera consommée pour atteindre l’équilibre. La même quantité (exprimée en rapports stoechiométriques) de produit a, sera formée :

Comme nous connaissons la valeur de K nous pouvons déterminer x et donc la concentration de chaque espèce.
Cette équation du second degré donne deux solutions mais l’une est négative et donc impossible (concentration négative est impossible). Nous pouvons ainsi déterminer les concentrations à l’équilibre pour toutes les espèces.
Si K est faible, par exemple dans la réaction, cela signifie que la réaction ne consomme pas beaucoup de réactifs.
à K=1.6 10-5 mole/l. Si nous commençons la réaction avec seulement 1 mole de NOCl (g) nous allons consommer 0.03mole/l de celui-ci.

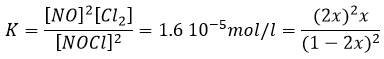
En supposant que x est faible la partie inférieure de la fraction est simplifiée et :
L’hypothèse selon laquelle 2x <<< 1 est correcte. Une petite constante d’équilibre signifie également que la réaction inverse est plus favorable (K ‘= 1/K).
Température d’inversion :
L’équilibre dépend de la température. Nous avons vu dans les sections de la thermodynamique que :
A une température donnée, les réactions vont dans un sens mais si nous augmentons la température suffisamment la réaction va aller dans la direction opposée. La température à laquelle l’inversion de la direction de la réaction se produit est la température d’inversion qui est égale à :
Si la réaction est effectuée à la p = 1 atm, nous pouvons trouver cette température à partir des tables de ΔH0 et ΔS0:
La modification de l’équilibre :
Maintenant si l’on considère un système à l’équilibre et que nous appliquons une modification sur ce système, Le Chatelier énonça que l’équilibre va changer pour contrebalancer cette modification.
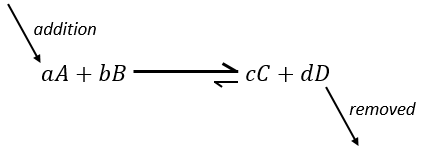
– Ajout d’un substrat : l’équilibre va consommer plus de ce constituant ou produire moins de celui-ci.
Par exemple prenons une réaction à l’équilibre :
si nous ajoutons plus de A dans le système l’équilibre va se déplacer vers la droite pour consommer une partie du réactif ajouté :
si on ajoutait une certaine C (un produit) l’équilibre serait déplacé vers la gauche :
Une autre façon de modifier l’équilibre est d’éliminer les produits du système pour déplacer l’équilibre vers la droite.
Pour optimiser la vitesse d’une réaction, on peut donc ajouter des réactifs et retirer les produits en permanence.
–Température : l’équilibre dépend de la température, comme nous l’avons vu ci-dessus. L’effet sera différent pour une réaction exothermique ou une réaction endothermique. En effet :
la variation de température affecte l’exponentielle avec ΔH0. Si ΔH0<0, soit il est une réaction exothermique, K diminue comme résultat d’une augmentation de la température et la réaction est donc moins efficace. Au cours d’une réaction exothermique la chaleur est un produit de la réaction :
et la température augmente si la chaleur de l’équilibre est déplacé vers la gauche. Si la réaction est endothermique (la réaction inverse par exemple), une augmentation de température aide la réaction à se dérouler (plus de chaleur est disponible pour être absorbée). L’équilibre est donc déplacée vers la droite.
– pression/volume : au cours des réactions impliquant des gaz, une diminution du volume déplacera l’équilibre vers le côté où il y a moins de moles de gaz. Dans la réaction précédente l’équilibre sera déplacé vers la droite car on génère deux moles de gaz à partir de 4. On peut également déplacer l’équilibre par addition d’un gaz inerte qui augmentera la pression sans aucune modification de la réaction chimique.
Experimental determination of K, ΔH0 and ΔS0
On sait que l’équilibre est déplacé par une modification de la température. Imaginons que nous voulons connaître les valeurs de K, ΔH0 et ΔS0 d’un processus de dissolution comme :
on sait que s’il n’y a pas de Ag+ ou Cl– dans la solution avant la réaction leur concentration sera égale car durant la réaction chaque ion est produit de manière égale. Comme les solides ont une activité a = 1, la constante de dissociation est Ks :
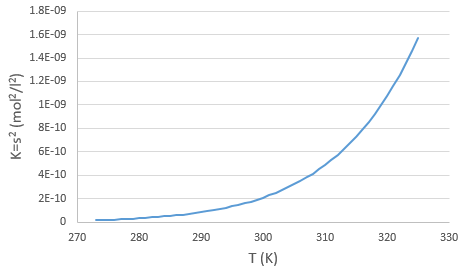
La concentration en ions est donc égale à la racine carrée de la constante de dissociation. A une température donnée on peut donc mesurer la concentration à l’équilibre de l’un des ions pour déterminer la valeur de K. On peut faire cela à plusieurs températures et tracer la relation entre la température et K.
Nous voyons que la constante de dissociation K augmente avec la température ce qui signifie que, si nous augmentons la température, nous pouvons dissoudre plus de AgCl en solution. AgCl n’est pas très soluble dans l’eau : seulement …. mg par litre va se dissoudre (la racine carrée de Ks donne la concentration). Mais nous pouvons trouver plus d’informations à partir de cette relation. Nous connaissons déja l’équation reliant K et T :
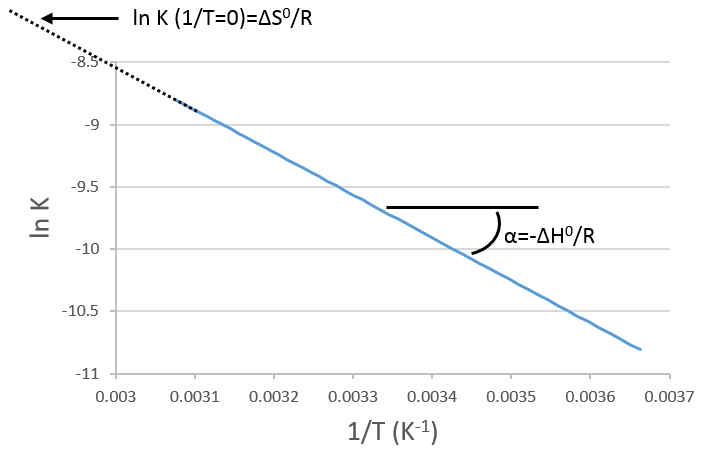
Si nous traçons ln K en fonction de 1/T nous trouvons une ligne droite dont la pente est égale à ΔH0/R :
L’intersection avec l’axe à 1/T = 0 nous donnera ΔS0/R. Sur la figure l’axe n’ est pas à 1/T = 0 et l’intersection de la courbe avec l’axe ne signifie rien.
Chez le vivant ΔG est généralement très proche de zéro, de sorte qu’un stimulus peut permettre à une réaction d’avoir lieu. Dans notre corps, beaucoup de réactions, qui seraient normalement impossibles, fonctionnent car elles sont couplées avec l’élimination du phosphore d’un ATP pour permettre au processus d’avoir lieu. L’ATP est une réserve d’énergie de notre corps.
La cinétique chimique :
la cinétique est un domaine de la chimie qui étudie la vitesse des réactions. La vitesse de réaction peut dépendre des conditions de la réaction. Par exemple lorsque nous avons mis H2(g) et O2(g) nous ne produisons pas de l’eau spontanément :
Cette réaction a une ΔG0 très négatif. Cependant, si nous produisons une étincelle, la réaction va aller très vite.
Nous avons vu que la température a une influence sur l’équilibre des réactions. Au SCTP, la formation d’ammoniac a une ΔG0 négative mais elle devient positive à des températures de plus de 434 K.
Sans variation de température une réaction peut être accélérée si l’on utilise un catalyseur. Nous allons discuter des catalyseurs plus loin dans ce chapitre.
Il peut donc être important de connaître la vitesse des réactions en fonction de plusieurs paramètres afin d’optimiser la production d’une molécule particulière, la destruction de certains déchets ou tout autre procédé.
Vitesse de réaction :
La vitesse d’une réaction est une variation de la concentration des espèces engagées dans la réaction en fonction du temps. Elle est toujours positif. Comme il peut y avoir plusieurs coefficients stoechiométriques différents, nous devons nous entendre sur la définition de la vitesse d’une réaction parce que les concentrations ne varient pas de la même façon. Pour obtenir cette vitesse on divise la variation dans le temps de la concentration des espèces correspondantes par le coefficient stoechiométrique. Dans la réaction :
nous ne considérons qu’une seule vitesse de réaction qui est :
Les concentrations des réactifs diminuent au fil du temps et la vitesse est de signe opposé à la variation de leur concentrationb :
Pendant la réaction la vitesse dépend de la concentration de toutes les espèces impliquées.
les coefficients α, β et γ sont de l’ordre de la réaction en ce qui concerne les espèces correspondantes et leur somme α + β + γ est de l’ordre global de la réaction. L’ordre de la réaction à l’égard de l’une des espèces est souvent leur coefficient stoechiométrique mais pas systématiquement.
A l’équilibre la vitesse de la réaction dans une direction est égale à la vitesse de la réaction dans l’autre sens :
il est faux de dire que v = 0. Les deux réactions ont la même vitesse.
Au début de la réaction on peut négliger les concentrations des produits de la réaction dans l’expression de la vitesse car β = γ = 0. La vitesse au début de la réaction est donc simplement :
Méthode intégrale :
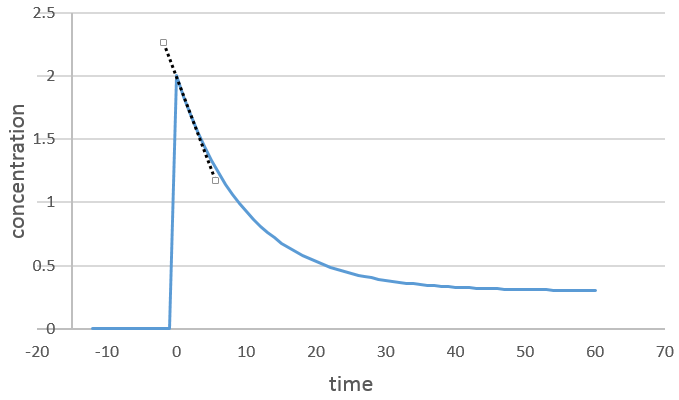
On peut déterminer l’ordre de la réaction en ce qui concerne une espèce en gardant constante la concentration des autres réactifs. Fondamentalement nous mettons les réactifs en excès, sauf pour les espèces que nous voulons étudier. De cette façon seulement une concentration varie de façon significative. Pendant la réaction on détecte la variation de la concentration de l’espèce cible dans le temps :
Nous nous concentrons sur la période de temps juste après le début de la réaction. Avant cela il n’y a pas de variation à détecter (le réactif n’est probablement même pas dans la solution) puis les produits peuvent jouer un rôle dans la vitesse de réaction.
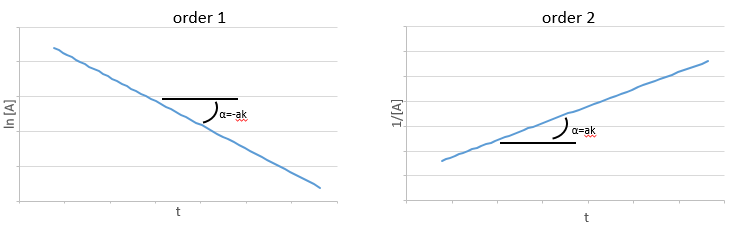
Si la réaction est de l’ordre 1 à l’égard de l’espèce cible, la vitesse est :
et ainsi nous pouvons trouver une ligne droite lorsque nous traçons ln [A] en fonction du temps dont la pente est -ak :
Si l’ordre = 2, les ln [A] ne donnera pas une ligne droite, mais 1/[A] le fera. Dans ce cas la pente est ak :
La commande peut également être égal à zéro, ce qui signifie que la concentration du réactif n’a pas d’importance (sauf pour de très faibles concentrations). Cela signifie que la réaction est limitée par quelque chose d’autre. Nous observons souvent un ordre zéro réaction en présence d’un catalyseur.
Un catalyseur est une espèce qui affecte la réaction mais n’est pas consommé pendant la réaction. Les catalyseurs les plus communs sont des solides mais certains catalyseurs sont des liquides. Sur les catalyseurs solides les réactifs peuvent se lier. En raison de cette nouvelle liaison, les liaisons dans le réactif sont plus faibles et la réactivité est améliorée. La réaction est ainsi limitée par l’espace disponible sur le catalyseur. La solution est mélangée au cours de la réaction afin qu’il y ait toujours des réactifs au voisinage du catalyseur. Sinon, les réactifs, seront de plus en plus loin du catalyseur au fur et à mesure que le temps passe. L’évolution de la concentration serait plus complexe dans ce cas. Nous allons discuter plus longuement à propos des catalyseurs dans un autre chapitre.
Méthode des vitesses initiales :
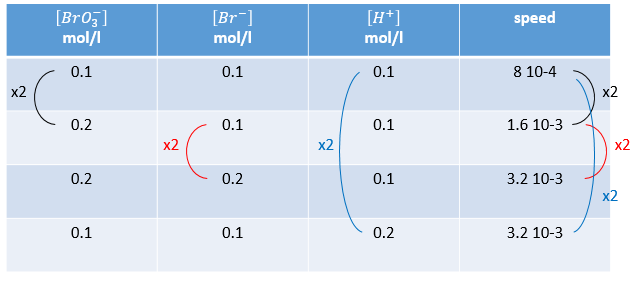
Au lieu d’utiliser des excès de réactifs, nous pouvons faire plusieurs expériences et varier chaque fois la concentration d’une espèce. La réaction suivante :
n’est évidemment pas une simple réaction. La vitesse dépend simultanément des trois réactifs BrO3–, Br– et H+. Nous faisons d’abord la réaction avec des concentrations identiques [BrO3–] = [Br–] = [H+] = 0,1. On analyse l’évolution de la concentration d’une espèce en fonction du temps et on ne considère que la variation de la concentration directement après le début de la réaction pour déterminer une vitesse de la réaction.
Dans un second temps nous faisons la même réaction mais modifions la concentration d’un réactif. La vitesse de réaction va changer en conséquence et nous pouvons déterminer l’ordre pour chaque espèce. Finalement lorsque nous savons tous les ordres nous pouvons déterminer la valeur de k.
Chemical kinetics is the study of the speed of reactions. The speed of reaction is determined by the variation of the quantity of species by unit of time. Usually, we consider the concentrations for species in solution and we consider pressures for gases.
The speed of a reaction is rarely constant and is positive until the system reaches the equilibrium. At the equilibrium, the speed of reaction is zero.