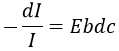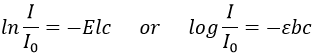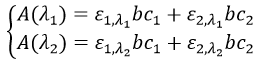Les méthodes spectroscopiques sont destinées à déterminer la composition des échantillons contenant une ou plusieurs espèces sur la base de leurs niveaux d’énergie. Nous avons vu que les électrons des atomes n’ont pas accès à toutes les valeurs de l’énergie. Ils sont limités à quelques valeurs de l’énergie, l’énergie’S (niveaux orbitales 1s, 2s, 2p, etc), sur lesquels ils sont distribués suivant la règle de Fermi en commençant par les niveaux d’énergie avec des énergies plus faibles et en remplissant les niveaux jusqu’à ce qu’il n y ai plus d’électrons à placer.
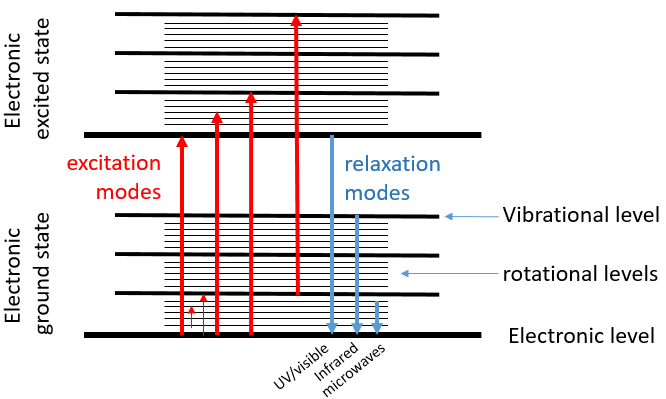
Les électrons de plus haute énergie peuvent être excités et atteindre les orbitales d’énergies plus élevées si elles reçoivent le montant exact des AE de l’énergie séparant les deux niveaux d’énergie, sous forme de chaleur ou de photons. Nous disons que l’électron passe de son état fondamental à un état excité.
Quand un électron excité revient à son état fondamental il génère un photon avec la même énergie AE = hv. La fréquence du photon est caractéristique de l’atome ou de la molécule à partir de laquelle il est émis. La ν de fréquences, comme une unité de mesure, est le nombre de fois que le processus se produit sur une période d’une seconde. Dans le cas des photons c’est le nombre d’ondes qui passe par un point durant une seconde (unités : Hertz). La longueur d’onde λ = c/ν est la longueur d’une onde ou la distance entre deux sommets, en mètres. Le nombre d’onde n est égal à l’inverse de la longueur d’onde (1/λ, les unités : cm-1). La différence entre la fréquence et le nombre d’onde est que le nombre d’onde n’a rien à voir avec la vitesse de l’onde. Il est donc utile pour des situations où la vitesse ou la fréquence ne sont pas fixes.
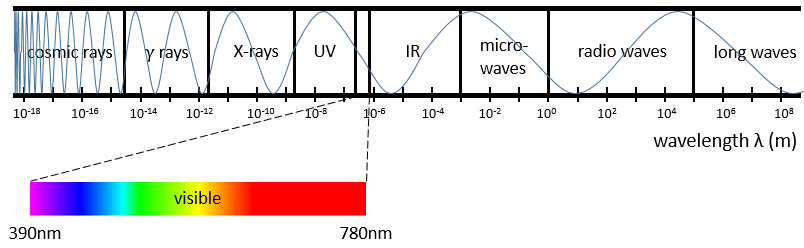
Par exemple lorsque nous chauffons un métal il change de couleur parce que les électrons excités émettent des photons dans la gamme du visible. Le spectre du visible est composé de toutes les couleurs que les humains peuvent voir. Chaque couleur correspond à un photon d’une longueur d’onde donnée. Le violet est la couleur visible avec la plus petite longueur d’onde (390 nm) ou le plus grand nombre d’ondes et le rouge est la couleur visible qui possède la plus grande longueur d’onde (780 nm) ou le plus petit nombre d’onde. Ironiquement la couleur que nous voyons sur un matériau donné n’est pas la couleur que le matériau absorbe mais plutôt les couleurs qui n’ont pas été absorbées et qui sont donc réfléchies par le matériau vers notre œil.
Les radiations ne sont pas limitées au spectre visible. Il existe des photons de longueur d’onde au-dessus de 780 nm et en-dessous de 390 nm. Les radiations avec un nombre d’onde plus petite (la longueur d’onde plus grande) que le spectre visible sont appelées infrarouge (le rouge étant la couleur avec le plus petit nombre d’onde = une avec la plus grande longueur d’onde). Si nous continuons de diminuer le nombre d’onde (ou d’augmenter la longueur d’onde) nous atteignons les micro-ondes, puis les ondes radio. De l’autre côté du spectre visible l’on retrouve les rayonnements ultraviolets (le violet le plus grand nombre d’onde ayant le spectre visible), puis les rayons X et les rayons gamma enfin. Comme l’énergie d’un photon est E = hv les photons gagnent de l’énergie quand nous allons à partir des ondes radio vers les rayons gamma. Les rayons X ont assez d’énergie pour extraire un électron profond (pas d’électron de valence) à partir d’un atome. Pas besoin de dire les dommages que les rayons gammas, à partir d’éléments radioactifs, peuvent faire.
Les transitions électroniques dont nous avons parlé précédemment correspondent à des radiations dans l’UV/spectre visible. Ces transitions ne sont pas les seules transitions qui peuvent avoir lieu. Entre chaque niveau électronique nous trouvons les niveaux de vibration et entre les niveaux de vibrations, nous trouvons les niveaux de rotation. Les transitions entre les niveaux de vibration sont de l’ordre de l’IR tandis que les transitions du niveau de rotations sont dans la gamme des micro-ondes. Ces transitions conduisent à une émission de chaleur et c’est exactement comme ça que le four à micro-ondes fonctionne: la nourriture est bombardée par des radiations dans la gamme des micro-ondes et la rotation des molécules de la nourriture génère le chauffage de celle-ci.
La spectroscopie
L’absorption des radiations d’une solution dépend donc de sa composition. Nous pouvons mesurer si une solution absorbe un rayonnement donné ou comment cette solution émet des photons lorsque ses molécules sont excitées.
La spectroscopie d’absorption
L’absorbance A d’une solution est sa capacité à bloquer/absorber les radiations. L’absorbance A dépend de la longueur d’onde(λ) du rayonnement.
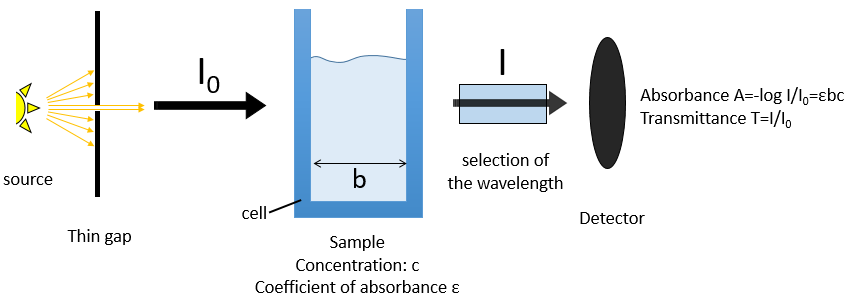
Si l’on considère un rayon entrant avec une intensité I0 qui se dirige vers une cellule de longueur b contenant une solution avec une concentration c, l’intensité I du rayonnement derrière la cellule est réduite par dI proportionnellement à la longueur de la cellule (une cellule plus longue absorbe plus) et de la concentration de la solution (une solution plus concentrée absorbe plus).
E est le coefficient d’absorbance de la solution qui ne dépend pas de la concentration ni sur la taille de la cellule et dc est la concentration de la solution à travers laquelle le rayon passe, à savoir la différence de concentration entre l’intérieur et l’extérieur de la cellule. Nous pouvons réécrire cette expression comme :
et on peut intégrer dI et dc entre l’émission du rayon et sa détection, soit à partir de I = I0 à I = I et de c = 0 à c. Il donne :
L’absorbance est donc donnée par la loi de Beer-Lambert
On peut aussi définir la transmittance qui est T = I/I0.
L’absorbance est donc directement proportionnelle à la concentration de la solution. Des déviations de la ligne droite peuvent être observées pour les solutions concentrées (c≠activité) ou si certaines molécules de l’échantillon sont impliquées dans un équilibre.
Les parois de la cellule sont fabriquées de telle manière à laisser passer un maximum de rayons. Ils sont généralement en quartz (transparent entre 200 et 380 nm). Une variation de l’intensité du rayon peut cependant être observée mais peut être déterminée en utilisant une solution blanche, à savoir une solution contenant seulement le solvant, avec c = 0 ou une référence. Le détecteur peut être configuré pour définir T = 1 (ou A = 0) avec la solution « blanc ». Comme l’absorbance est directement proportionnelle à la concentration de la solution on peut déterminer la concentration de l’échantillon si nous avons mesuré l’absorbance de notre solution blanc et d’une solution étalon dont la concentration est connue.
Si plusieurs espèces se trouvent dans la solution l’absorbance est la somme des absorbances individuelles.
Pour déterminer les concentrations nous avons besoin de répéter l’expérience avec plusieurs longueurs d’onde. Ne pas oublier que l’epsilon dépend de la longueur d’onde.
Nous pouvons ainsi déterminer C1 et C2 si les εi sont connus.
Installation expérimentale :
L’instrument est composé de 5 grandes parties :
– une source stable de l’énergie rayonnante.
– un dispositif transparent destiné à contenir l’échantillon.
– un système pour sélectionner une gamme de spectre.
– un détecteur qui peut transformer le signal lumineux en un signal électrique.
– un dispositif pour traiter le signal.
La source du rayon doit être une lampe monochromatique envoyant uniquement des photons de longueur d’onde donnée. Il peut être par exemple une lampe à cathode creuse ou une source laser. Cependant il y a toujours une petite gamme de longueurs d’ondes qui est émise. L’impact peut être limité si la longueur d’onde est de sorte que les coefficients de ε ne varient pas trop sur cette gamme de longueurs d’onde.
La cellule est généralement en quartz et sa taille est généralement de 1 cm de long pour la spectroscopie des solutions. Pour les gaz l’épaisseur est comprise entre 1 et 100 mm mais le rayon peut passer plusieurs fois dans la cellule, avec l’utilisation de miroirs, donnant chemins optiques jusqu’à 120m. Il est également possible de permettre un écoulement de gaz.
La sélection de la longueur d’onde est réalisée par une combinaison de prismes/miroirs et les lacunes (gaps) minces. Les prismes séparent les longueurs d’onde de la lumière incidente et les lacunes (gaps) permettent seulement une petite gamme de longueurs d’onde pour passer vers le détecteur.
Le détecteur peut également introduire des erreurs dans la mesure. L’intensité relative de ces erreurs est grande lorsque A →0 ou lorsque A est grand. Encore une fois, un bon choix de longueur d’onde limite les erreurs expérimentales.
Spectroscopie moléculaire :
Une autre façon d’utiliser les propriétés d’absorption des solutions consiste à balayer une gamme de longueurs d’onde et à détecter l’absorbance. Il nécessite une source de lumière capable de changer de longueur d’onde. S’il n’y avait que les niveaux électroniques nous obtiendrions des rayons discrets correspondants à la quantité exacte d’énergie de la transition entre l’état fondamental de l’électron et un état excité. Cependant les sous-niveaux de rotation et de vibration transforment les rayons en bandes. Les bandes sont amincies si nous effectuons la spectroscopie des gaz. Dans le cas de la spectroscopie d’absorption UV-visible, cette technique est surtout utilisée quantitativement. Par exemple nous pouvons suivre l’évolution d’une réaction à travers le spectre d’absorbance. Si les produits et les réactifs absorbent à différentes longueurs d’onde, l’intensité des pics caractéristiques des produits augmente avec le temps tandis que les sommets des réactifs diminuent en taille.
Chromophore : c’est un groupe organique insaturé covalent qui absorbe dans l’UV (ex: C = C, C = O, NO2) avec des électrons qui peuvent être délocalisés. Les photons excitent les électrons qui sautent entre les niveaux d’énergie qui sont des orbitales π étendues, créés par une série d’alternance de liaisons simples et doubles, souvent dans des systèmes aromatiques.
Auxochrome : un groupe saturé avec des électrons libres qui modifient l’intensité et la longueur d’onde de l’absorption lorsqu’il est lié à un chromophore.
Déplacement bathochromique : déplacement de l’absorption vers les longueurs d’onde plus grande (déplacement vers le rouge) en raison d’un effet de solvant ou d’une substitution.
Déplacement hypsochromique : déplacement de l’absorption vers les longueurs d’onde plus petites (déplacement vers le bleu) en raison d’un effet de solvant ou d’une substitution.
Hyperchromicité : augmentation de l’intensité de l’absorption.
Hypochromicité : diminution de l’intensité de l’absorption.