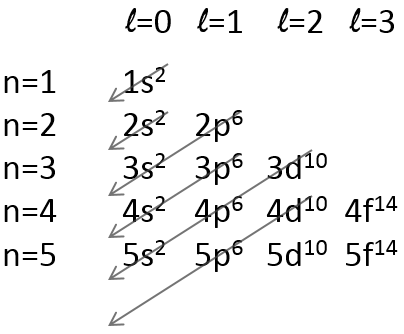
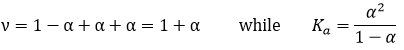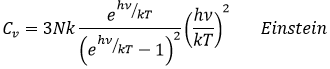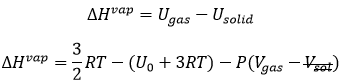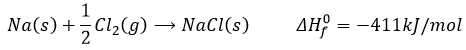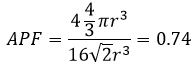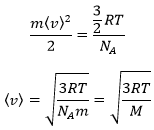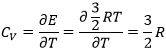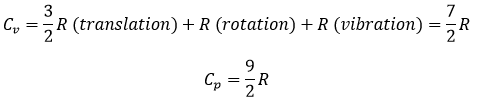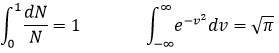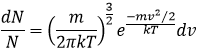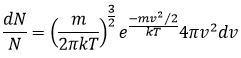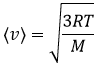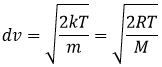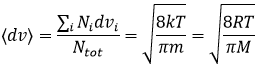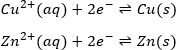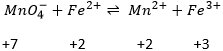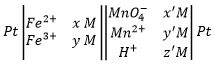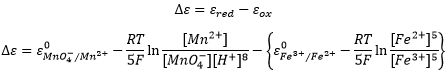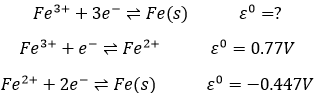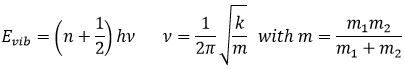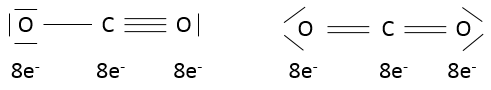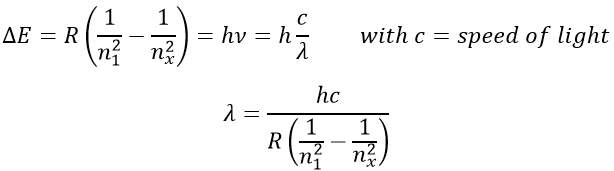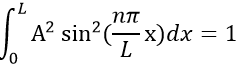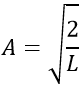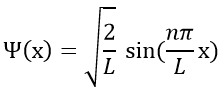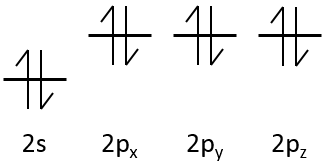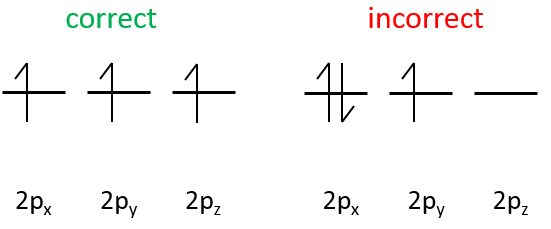Chapitre 10 : Diagramme de phase
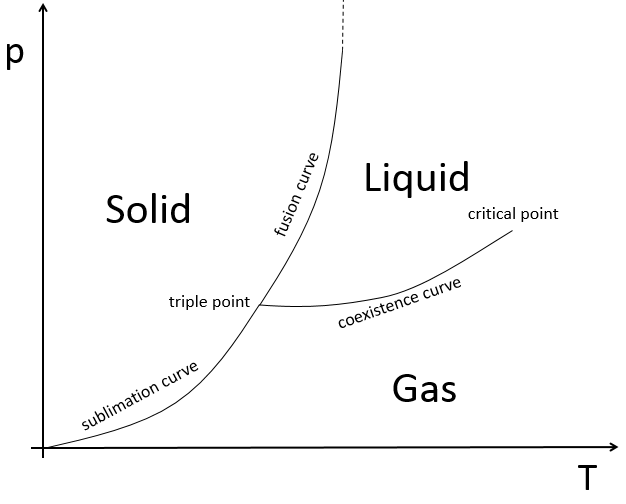
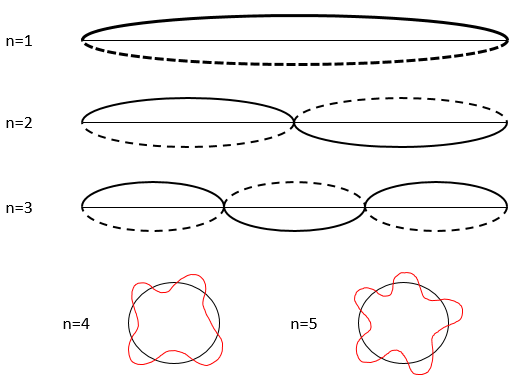
L’état des composés dépend de la température et de la pression. Nous cartographions les états de la matière sur le diagramme de phases. La pression est mise en ordonnée et la température en abscisse :
Les états sont séparés par des traits pleins ce sont les courbes de transition de phase. La courbe entre le liquide et le solide est appelée la courbe de fusion.
La courbe entre le liquide et le gaz est appelé la courbe de vaporisation/ coexistence. La courbe entre le solide et le gaz est appelée la courbe de sublimation.
Courbe de vaporisation :
Dans un système fermé contenant un liquide et un gaz il existe un équilibre entre les deux phases. Le gaz devient liquide à une vitesse donnée vGL et le liquide devient gaz à une vitesse donnée vLG. L’équilibre est atteint lorsque les vitesses sont égales.
Le liquide devient un gaz si les molécules ont une énergie cinétique suffisamment grande. Si cette énergie n’est pas assez grande les molécules restent liquides en raison des interactions entre les molécules. L’énergie cinétique peut être fournie par chauffage ou excitation. Typiquement nous devons chauffer l’eau pour la faire bouillir.
La réaction inverse, c.à.d la transformation d’un gaz à un liquide, est favorable mais pas complète en raison de l’entropie. L’entropie est une expression du désodre dans le système. La deuxième loi de la thermodynamique impose que l’univers évolue vers un plus grand désordre. Cela signifie que la somme des variations d’entropie à l’intérieur et à l’extérieur du système doit être positive :
Il existe donc une compétition entre l’augmentation de l’entropie et la diminution de l’énergie dans le système.
L’enthalpie libre de Gibbs représente/reflète cette compétition :
L’enthalpie libre de Gibbs est donc un potentiel thermodynamique tenant compte des implications du système sur son environnement.
La pression de vapeur dans le système à l’équilibre p° (également appelée la pression de Clausius-Clapeyron) est :
Les termes entropiques sont présents dans le pré-exponentiel constant et l’enthalpie est dans le terme exponentiel. Lorsque la température augmente la pression de vapeur augmente de façon exponentielle. Expérimentalement nous pouvons trouver l’enthalpie de vaporisation en traçant la courbe
ln p° vs 1/T :
La pente de la courbe est -AH / R. La valeur de ΔHvap dépend des interactions entre les molécules. Des interactions fortes font que les molécules ne sont pas facilement séparables les unes des autres et que la vaporisation nécessite plus d’énergie, soit ΔHvap est grand et p° est faible. Il est logique : si les molécules ne se vaporisent pas facilement il n’y a pas beaucoup de molécules dans le gaz et la pression de la vapeur est donc faible.
Dans le cyclohexane il n’existe pratiquement aucune interaction entre les molécules et son ΔHvap est faible. Le cyclohexane est un liquide volatil.
La température d’ébullition d’un liquide est la température à laquelle la pression de vapeur d’un liquide est égale à la pression atmosphérique. Pour l’eau cette température est de 373K (100° C) si la pression atmosphérique est de 1 atm. En altitude la pression atmosphérique diminue et il en va de même pour la température d’ébullition. Par exemple la température d’ébullition est de 363K (90° C) à une altitude de 3000 m. Dans une cocotte-minute, la pression est supérieure à 1 atm et l’eau bout à une température supérieure à 100° C.
Courbe de sublimation :
la sublimation est la transition de phase entre un solide et un gaz :
Nous pouvons définir une pression de vapeur pour les solides aussi mais il est beaucoup plus faible que pour un liquide parce que les interactions dans un solide sont plus fortes que dans un liquide. L’équation est similaire :
mais la constante est différente et ΔHsub>>ΔHvap, pour exactement les mêmes raisons.
La courbe de fusion :
la fusion est la transition de l’état d’un solide à un liquide.
On peut aussi définir une pression telle que
L’enthalpie de fusion est très faible et la courbe est presqu’une ligne droite verticale. En règle générale la pente est positive, ce qui signifie que, quand un liquide devient solide (par diminution de sa température par exemple), son volume diminue. Il est cependant pas toujours vrai. Un cas particulier est l’eau: le volume de 1 kg d’eau est inférieur au volume de 1 kg de glace. C’ est une astuce des barmens pour diminuer le volume de la boisson qu’ils donnent à leurs clients :
Le dioxyde de carbone dans un extincteur est à l’état liquide à proximité du point triple. Lorsque nous utilisons l’extincteur la pression chute brusquement. Nous devrions donc nous attendre à un gaz à l’extérieur du tube; Cependant il ya une détente du gaz pendant le processus (passage d’un espace étroit à un grand espace) qui implique une diminution de la température ce qui fait que le gaz devient un solide.
Variance :
c’est le nombre de degrés de liberté qui caractérisent un état :
Où C est le nombre de constituants de la matière et φ est le nombre de phases. Jetons un oeil à différents points sur le diagramme de phase :
-au milieu d’une phase : V = 1-1 + 2 = 2 : nous pouvons modifier la pression ou la température sans transition de l’Etat.
-sur une courbe : V = 1-2 + 2 = 1 : si nous voulons modifier la pression ou la température de la matière sans transition de l’Etat l’autre paramètre (T ou p) doit être fixe.
-sur le point triple : V = 1-3 + 2 = 0 : si nous voulons garder la question dans cet état, nous ne pouvons pas changer les conditions de température et de pression.
Au point triple l’enthalpie de sublimation est égale à la somme des enthalpies de vaporisation et de fusion. Le point triple de l’eau est à t = 273,16K et p = 0.006atm.
Après ce point les phases liquide et gazeuse deviennent indiscernables. Dans l’eau le point critique se produit à environ 647 K et 218 atm.
Au voisinage du point critique les propriétés physiques du liquide et de la vapeur changent de façon spectaculaire les deux phases deviennent de plus en plus similaires. Par exemple de l’eau liquide, dans des conditions normales, est presque incompressible, a un faible coefficient de dilatation thermique, a une constante diélectrique élevée et est un excellent solvant pour les électrolytes. Près du point critique l’eau devient compressible, extensible, un pauvre diélectrique, un mauvais solvant pour les électrolytes et préfère se mélanger avec les gaz non polaires et des molécules organiques.
Au point critique une seule phase existe. La chaleur de vaporisation est de zéro.
Au-dessus du point critique (T> Tc et p> pc) il y a un état de la matière qui est continuellement connecté, sans transition de la phase, à la fois avec le liquide et l’état gazeux : fluide supercritique. Un tel fluide a généralement des propriétés entre celles d’un gaz et d’un liquide.
Cas de mélanges :
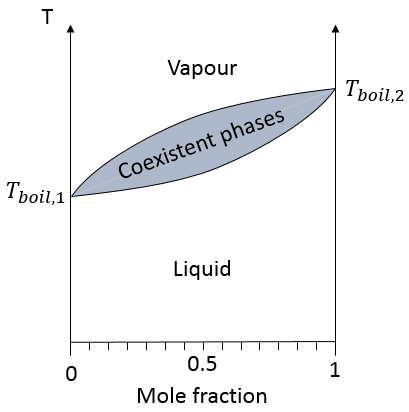
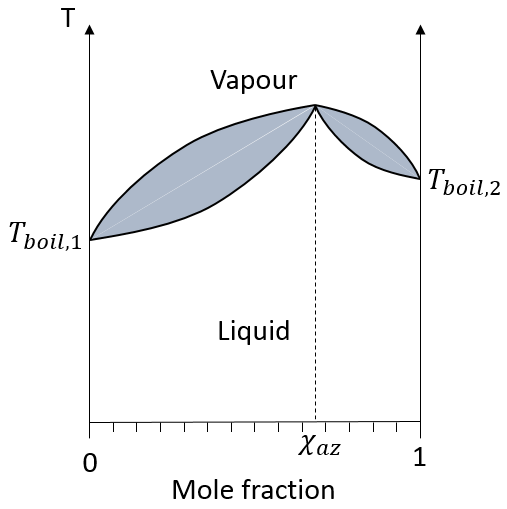
dans une solution les éléments du mélange ne doivent pas nécessairement avoir le même point d’ébullition. L’élément ayant le point d’ébullition inférieur va s’évaporer plus rapidement que les autres composants du mélange. Si l’on considère un mélange binaire, on peut tracer la composition du mélange en fonction de la température sur un diagramme montré ci-dessous :
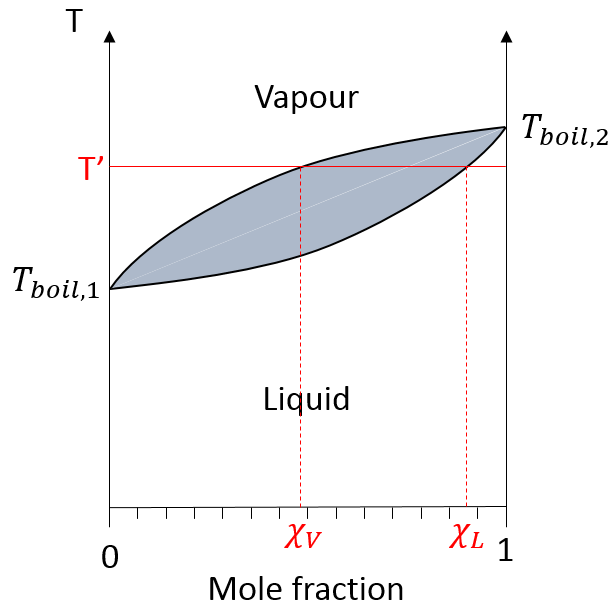
Sur ce diagramme la température est rapporté sur l’axe des ordonnées et la fraction molaire χ du deuxième composant du mélange est définie comme abscisse. A χ = 0, la solution est une solution pure du soluté 1 et la température d’ébullition de la solution est Tboil,1. A χ = 1, la solution est une solution pure du soluté 2 et la température d’ébullition de la solution est Tboil,2. Entre les deux la solution est un mélange des deux composants. Dans ce cas nous avons considéré une solution dans laquelle le soluté a une température d’ébullition plus basse que le soluté 2. Si l’on augmente la proportion du soluté 2 la température d’ébullition du mélange augmente. Cette augmentation n’est pas linéaire et on peut voir qu’il y a un domaine dans lequel, à la fois, la vapeur et le liquide coexistent. Si l’on regarde à une température donnée T la composition du liquide et de la vapeur est différente : la composition de la vapeur est constituée par une fraction plus importante du soluté qui est plus volatil que le liquide :
Distillation :
la distillation est un procédé de séparation basé sur la différence de température des différents solutés dans une solution bouillante. Fondamentalement si la solution initiale a une fraction molaire χL, nous pouvons faire bouillir à la température T ‘. L’objectif est de recueillir la vapeur et de la liquéfier. La solution recueillie a une composition χV. Nous pouvons continuer à faire cela plusieurs fois pour obtenir une solution quasiment pure du soluté 1 :
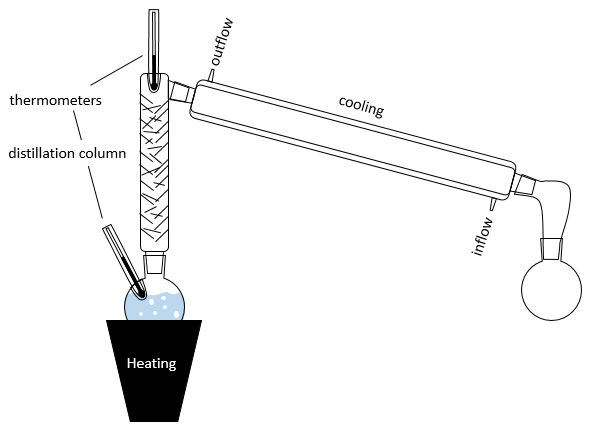
En pratique plusieurs distillations sont effectuées à la fois. L’installation se compose d’un ballon contenant la solution initiale un système de chauffage (comme une lampe infra-rouge), une colonne de distillation, d’un tube réfrigérant et d’un ballon pour recueillir le distillat. Les thermomètres peuvent être placés dans le premier ballon et au sommet de la colonne de distillation pour contrôler la température de la solution et de la vapeur :
Le dispositif de refroidissement est composé de deux tubes un mince placé à l’intérieur de l’autre. Le tube interne présente des ouvertures aux deux extrémités et est relié à la colonne et le ballon de collecte. L’autre tube a des ouvertures latérales connectées à un contre-courant d’eau fraîche. Le flux d’eau fraîche va de cette façon pour éviter une zone non chargée et aussi parce que l’eau près de la colonne, qui a été chauffée par la vapeur, est rapidement évacuée. Si l’eau allait dans le sens inverse l’eau serait chauffée par la vapeur et la puissance de refroidissement du tube serait diminuée.
La colonne de distillation peut être remplie de petits morceaux/tubes de verre pour augmenter la surface de contact avec de la vapeur. Dans certaines colonnes les aiguilles font partie de la colonne et il n’est pas nécessaire d’ajouter des pièces supplémentaires.
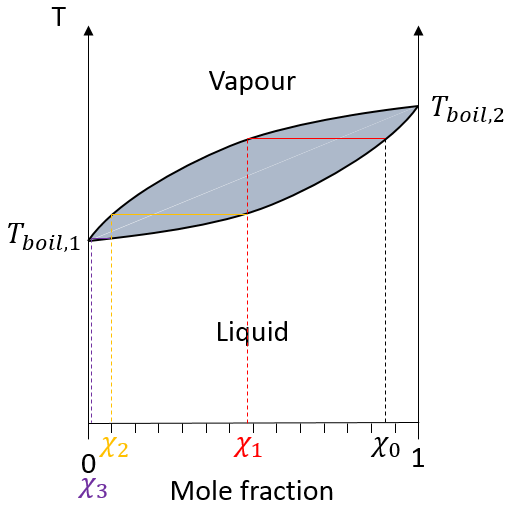
Dans la colonne de distillation de la vapeur chaude monte et remplit les morceaux de verre de plus basse température. A leur contact il y a un échange de chaleur et la vapeur peut redevenir liquide, pas avec la composition du liquide dans le ballon χ0 (pour maintenir la notation de la figure ci-dessus), mais la composition de la vapeur χ1. Les gouttelettes finiront par retomber dans le ballon ou s’évaporer sur leur chemin à cause de la vapeur chaude. Leur composition sera maintenant χ2 comme si deux distillations avaient été effectuées. La vapeur poursuit son chemin vers le sommet de la colonne, de plus en plus pur, et entre dans le tube de refroidissement où il se transforme en liquide terminant sa course à l’intérieur du ballon de collecte.
Il est bon de mettre quelques pierres ponces dans le ballon pour éviter la surchauffe et d’obtenir des bulles d’une taille controlée.
Azéotropes :
Le schéma de l’ébullition n’est pas toujours aussi simple. Certains mélanges sont dits azéotrope. Un mélange de type azéotrope se comporte comme une solution à un composant, à savoir, la fraction molaire ne change pas au cours de l’ébullition. Sur le diagramme les courbes ressemblent à :
Si la solution initiale a la composition azéotrope les compositions liquide et vapeur sont identiques et ne changent pas au fil du temps. Si la solution initiale possède une fraction molaire plus faible nous allons finalement obtenir une solution pure du soluté 1 mais il est impossible d’obtenir une solution pure du soluté 2 : la composition tend vers l’azéotrope. La même chose est vraie si la composition initiale du mélange possède une fraction molaire supérieure à χaz : il sera impossible d’obtenir une solution pure du soluté 1 dans ce cas.
Deux types d’ azéotropes peuvent être triés : les aspects positifs et les aspects négatifs. Les différences sont tout simplement leur température d’ébullition. Sur le schéma ci-dessus un azéotrope positif est représenté : sa température d’ébullition est supérieure à celles des composants purs du mélange. Un azéotrope négatif a une température d’ébullition plus basse.
Démixtion :
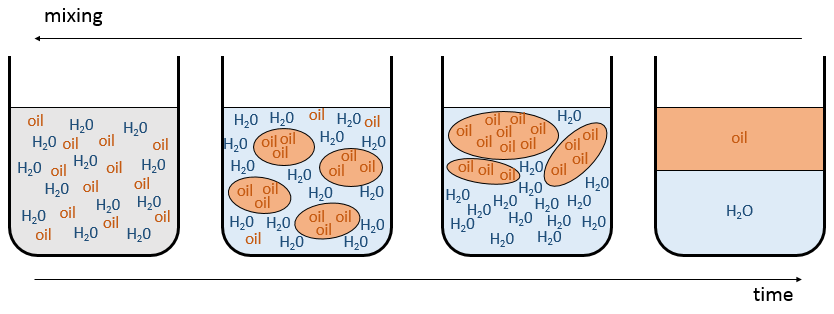
dans les mélanges les interactions différentes existent : les interactions entre deux molécules identiques et entre les différentes molécules du mélange si
puis le mélange a tendance à se séparer. L’expression ci-dessus signifie que les interactions entre les molécules identiques sont plus favorables que les interactions entre des molécules différentes. Imaginez que, dans ce cas, les molécules A et B sont parfaitement mélangés. Les interactions entre A et B ne sont pas nécessairement défavorable mais avec le mouvement brownien, les molécules ont tendance à se regrouper entre les espèces et elles forment des grappes/bulles d’avoir le maximum d’interactions favorables. Voilà comment les émulsions se forment. Les grappes vont fusionner ensemble au fil du temps pour améliorer le rapport volume/surface des grappes et la solution finira par finir comme deux phases séparées. C’est le phénomène de démixtion :
Par exemple l’huile et l’eau ne se mélangent pas bien : ils forment deux phases distinctes. Pourtant nous pouvons diluer un peu d’eau dans l’huile ou vice versa mais si nous continuons à ajouter de l’eau les phases vont se séparer comme indiqué sur la figure suivante :
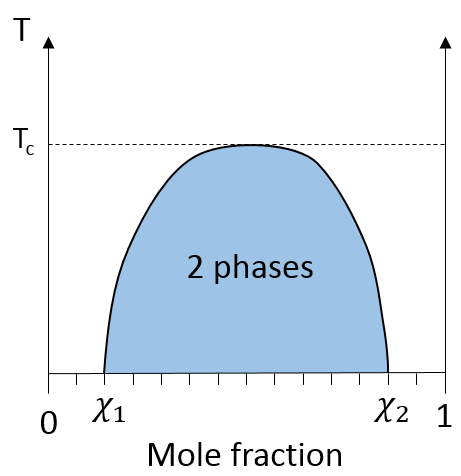
Si l’huile est la composante 1 et l’eau la composante 2, ce chiffre montre que nous pouvons ajouter de l’eau à l’huile jusqu’à la fraction molaire χ1 avant une séparation de phases. Nous pouvons ajouter de l’huile dans l’eau sans démixtion pour les fractions molaires de plus de χ2. Comme nous pouvons le voir le processus de démixtion dépend de la température. La quantité de soluté que l’on peut dissoudre avant la démixtion dépend de la température ambiante. Au-dessus d’une température critique (pas la même que dans le diagramme de phase), le mélange reste comme une phase quelle que soit la composition.
les propriétés colligatives :
Les propriétés colligatives sont des propriétés qui dépendent du nombre de particules dans le solvant, du solvant mais pas de l’espèce de soluté. Le fait que la température d’ébullition de l’eau augmente quand on ajoute un peu de sel est à l’intérieur d’une propriété colligative. Il n’a pas d’importance qu’il soit le sel ou autre chose, la température de congélation diminue aussi : nous utilisons du sel sur la neige pour la faire fondre. Dans le diagramme de phase la courbe de coexistence a été traduite vers le bas en raison de l’addition du sel. La loi ébullioscopique dit que :
Avec kb la constante ébullioscopique et ms la molalité du soluté. Lorsque nous ajoutons du sel dans l’eau nous ajoutons deux espèces : les ions Cl– et Na+. Il est donc préférable d’écrire cette relation comme suit :
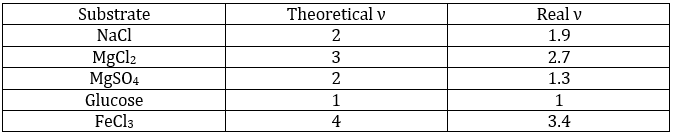
ν est appelé le facteur van’t Hoff et est le nombre d’ions trouvés par la formule unitaire. En fait nous observons que ce facteur est souvent plus petit que sa valeur attendue : quelques-unes des molécules ne se dissolvent pas dans la solutio :
Cela signifie que pour 100 molécules de NaCl en solution, 90 se dissolvent pour produire le Cl- ions et Na+ et 10 molécules ne se dissolvent pas (soit un total de 190 molécules au lieu de 200). ν peut être déterminé à partir de la constante de dissociation de la molécule. Par exemple toutes les molécules d’un acide faible ne se dissocient pas dans l’eau.
La Ka de cette réaction est :
Jetons un coup d’oeil à la concentration des espèces avant et après la réaction. En fait, au lieu des concentrations, nous allons considérer la concentration/ concentration initiale de CH3COOH :
Le nombre total de molécules est
Donc nous savons qu’il ya une diminution de la température en raison des propriétés colligatives. La variation de température est couplée à une variation de la pression de vapeur du mélange. Intuitivement la pression de vapeur du sel dissout est en général très faible en ce qui concerne la pression de vapeur de l’eau. Certains sels ne sont pas volatiles du tout. La pression est égale à la somme des pressions partielles
L’addition d’un sel B dans la so
Chapitre 9 : solides – conduction
Conduction électrique :
Certains solides conduisent l’électricité et certains ne le font pas. Nous allons voir d’où vient la conduction et la différence entre un conducteur et un isolant. La conduction est expliquée par la théorie de la bande.
Nous avons vu dans la section sur les orbitales moléculaires que les liaisons sont la combinaison des orbitales atomiques des atomes liés.
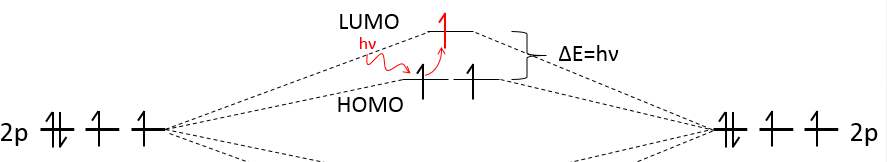
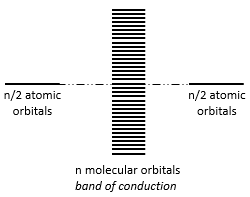
La largeur de la bande augmente avec le nombre d’atomes mais la différence d’énergie entre les orbitales moléculaires diminue de manière significative et dans les métaux les atomes sont tous liés entre eux menant à un continuum des orbitales moléculaires, une bande.
L’énergie nécessaire à un électron à sauter d’une orbitale inférieure à un niveau supérieur est donc petit à l’intérieur des groupes et une agitation thermique simple peut suffire.
Les bandes peuvent s’étendre sur une large gamme d’énergie mais il peut y avoir un peu d’espace entre les deux bandes des orbitales moléculaires. Les plages de l’énergie non couvertes par une bande sont appelées lacunes de la bande (band gaps). Dans certains cas il n’y a pas d’espace entre deux bandes: celles-ci se chevauchent.
Les électrons dans les solides respectent le principe d’exclusion de Pauli : les niveaux d’énergie inférieurs sont remplis d’abord et par paires d’électrons. L’orbitale moléculaire occupée la plus élevée est appelée HOMO et celle inoccupée, la plus basse, est appelée LUMO. La HOMO et la LUMO peuvent être dans la même bande ou dans des bandes séparées par un espace.
La distribution de Fermi-Dirac f (ε) donne la probabilité que (à l’équilibre thermodynamique) un électron occupe un état ayant une énergie ε.
T est la température, k est la constante de Boltzmann et μ est le potentiel chimique total. Le potentiel chimique est une forme d’énergie potentielle qui peut être absorbée ou libérée au cours d’une réaction chimique ou d’une transition de phase.
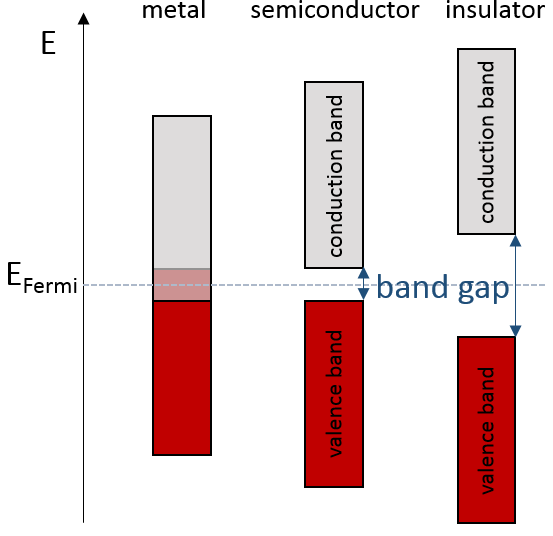
S’il y a un état au niveau de Fermi (ε = μ), alors cet état aura une chance de 50% d’être occupé à un moment donné. C’est au voisinage du niveau de Fermi que l’on trouve les orbitales LUMO et HOMO. La conductivité d’un solide dépendra de la capacité des électrons de passer d’une orbitale HOMO à une orbitale LUMO. Dans un métal le niveau de Fermi se trouve dans une bande et il est donc très facile pour les électrons de sauter de la HOMO à une orbitale inoccupée. Rappelez-vous aussi que dans les métaux certains électrons ne sont pas liés à des atomes mais sont partagés et peuvent se déplacer à l’intérieur du solide. Pour ces raisons les métaux conduisent bien l’électricité.
Le niveau de Fermi dans les semi-conducteurs est dans un petit espace. Il est alors nécessaire de donner une énergie supplémentaire, équivalente à l’écart de l’énergie, aux électrons pour leur faire atteindre la LUMO. La bande juste en-dessous du niveau de Fermi est appelée la bande de valence du fait que les électrons de valence sont en équilibre dans cette bande. La bande juste au-dessus du niveau de Fermi est appelée la bande de conduction. Un semi-conducteur conduit l’électricité lorsque les électrons peuvent passer de la bande de valence à la bande de conduction. Dans un isolant l’écart est plus grand et il est donc difficile pour les électrons d’atteindre la bande de conduction.
La supraconduction :
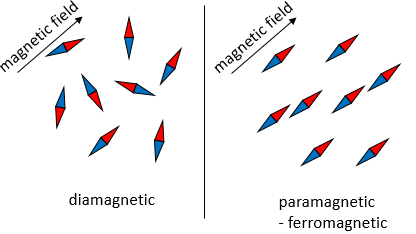
Compte tenu de cela une augmentation de la température conduit à une meilleure conduction. Cependant ce n’est pas toujours vrai. Les superconducteurs sont des matériaux particuliers dont la résistance tombe à zéro quand ils sont refroidis en dessous d’une température critique qui peut varier en fonction du matériau des supraconducteurs. C’est un phénomène de la mécanique quantique caractérisé par l’effet Meissner : quand un supraconducteur est placé dans un champ magnétique externe faible et refroidi en dessous de la température critique, le champ magnétique ne peut plus pénétrer dans le matériau (en fait, il le fait mais seulement sur une très petite distance). Dans les supraconducteurs les électrons sont liés par paires, appelées les paires de Cooper. Malgré la répulsion à laquelle nous pouvons nous attendre entre deux électrons, une attraction peut exister à des températures très basses en raison de l’interaction électron-phonon. Un phonon est un mode de vibration des atomes du réseau. La vibration a une fréquence donnée et donc une énergie (E = hv). Les électrons d’une paire de Cooper ne sont pas nécessairement proches parce que cela est une interaction à longue portée. Cette interaction est très faible mais si l’on considère de nombreuses paires d’électrons le jumelage ouvre une brèche dans les états d’énergie permises des électrons. Cet écart empêche les petites excitations des électrons ce qui conduit à une chute de la résistance électrique à zéro et la supraconduction.
Les supraconducteurs sont également des électro-aimants les plus puissants. Ils sont utilisés dans plusieurs applications. L’un d’eux est le train le plus rapide sur terre, le Maglev, qui utilise des aimants superconducteurs pour faire léviter plusieurs centimètres au-dessus des rails.
Conduction thermique :
La conduction thermique est la quantité de chaleur qui se propage à travers un matériau par unité de temps. Plus la conduction thermique est élevée, plus un matériau est conducteur de la chaleur. Un produit d’isolation a une faible conduction thermique. Une conduction thermique de 1 Wm-1K-1 est la quantité de chaleur qui se propage sur 1 seconde à travers un bloc de matériau avec une surface de 1m2 et une largeur de 1 m quand une différence de température de 1K est appliquée entre deux faces opposées du matériau.
La chaleur se propage à partir de l’emplacement le plus chaud vers l’emplacement le plus froid. Cela peut sembler évident mais quand nous touchons quelque chose de froid, le froid ne vient pas de l’objet froid vers nous mais plutôt c’est nous qui donnons la chaleur à l’objet froid.
Quand nous cuisinons, la poignée des casseroles sont isolés afin que nous puissions les attraper sans nous brûler les mains. La casserole elle-même doit être un bon conducteur de chaleur.
Les défauts dans les cristaux :
L’arrangement dans un cristal est rarement parfaite. En fait, sauf à 0 K, les solides ont des défauts dans leur arrangement. Il est le résultat de la deuxième loi de la thermodynamique (chapitre suivant) qui dit que le trouble de l’univers doit augmenter pendant tout processus. Une faille dans un cristal augmente le désordre dans le cristal : il n’y a qu’une seule façon de procéder à un arrangement parfait des atomes mais il y a beaucoup de possibilités pour placer une faille dans cet arrangement.
En conséquence le cristal parfait est uniquement possible au zéro absolu. Pour de plus grandes températures le cristal a une certaine énergie à partir de la chaleur qui est transformée en énergie potentielle par des défauts.
Différents types de défauts existent :
Défaut ponctuel : un atome individuel n’est pas placé correctement dans l’arrangement. Plusieurs cas peuvent être triés:
1) Un atome est manquant dans le dispositif : il a été expulsé de l’âme du cristal à la surface. Il est appelé un défaut de Schotty.
2) Un atome est au mauvais endroit : l’atome est encore dans le noyau du cristal mais pas aligné avec les autres atomes. Il est appelé un défaut de Frenkel.
3) Un atome a été remplacé par un autre.
Défauts linéaires : une ligne d’atomes est hors de l’arrangement.
Les défauts des plans : ils viennent de la fusion de deux cristaux qui croissent dans des directions différentes.
Les alliages :
Un alliage est un solide composé de plusieurs éléments et ayant les propriétés d’un métal. Différents types d’alliages existent :
Alliage de substitution : des atomes du métal sont remplacés par d’autres atomes de taille similaire. L’acier inoxydable est un alliage de substitution dont certains sont remplacés par Fe Cr et Ni, respectivement dans les proportions de 18% et 8%.
Alliage interstitiel : petits éléments sont ajoutés dans les interstices entre les atomes du réseau. Si vous vous souvenez nous avons vu qu’ il y a beaucoup d’espace vide dans les cristaux et les petits ions peuvent être insérés dans les trous entre les atomes.
Alliage mixte : il est une combinaison de l’alliage interstitiel et de l’alliage de substitution.
Les propriétés des alliages dépendent des éléments composant l’alliage et peuvent changer de façon drastique les propriétés du métal principal. Un métal comme l’aluminium qui est flexible peut devenir dur si nous le mélangeons le manganèse avec elle. Cependant, ce mélange rend le solide très sensible à l’eau.
Le dopage des semi-conducteurs :
Les semi-conducteurs peuvent être dopés par l’addition intentionnelle d’impuretés dans leur structure. Les impuretés ont pour effet d’ajouter ou de retirer des électrons de la grille. Dans le cas des électrons supplémentaires ceux qui sont destinés à combler le déficit de bande entre la valence et les bandes de conduction. Suppression des électrons proviennent de la bande de valence de sorte que l’écart est déplacé.
Les semi-conducteurs de la colonne IVa sont dopés par des éléments des colonnes IIIa ou Va. Le remplacement d’un Si par un P (Va) augmente la quantité d’électrons dans le réseau. C’est aussi le cas quand un élément de la colonne III a (comme B) est inséré dans les trous de la grille. Un dopage où les électrons sont introduits dans le réseau est appelé de type N (n pour négatif) ou de type n. Nous disons aussi que Si utilise P comme un donneur (d’électrons).
Les éléments de la colonne IIIa peuvent également remplacer des atomes de Si dans le réseau. Dans ce cas le réseau perd un électron par atome remplacé. L’atome inséré, Al par exemple, a un électron de moins que les autres atomes. Il crée un «trou positif» dans le réseau. Un dopage où les électrons sont enlevés de la grille est appelé le type p (p pour positif ) ou de type p. Nous disons aussi que Si utilise Al comme un capteur (des électrons).
Les semi-conducteurs ou les autres colonnes peuvent également être dopés de la même façon par les éléments d’une colonne inférieur ou supérieur.
Les diodes
Une diode de type p-n jonction est constituée d’un cristal semi-conducteur : des impuretés sont ajoutées pour créer, sur un côté, une région qui contient des électrons pour la formation d’un semi-conducteur de type n et de l’autre côté une région qui contient des trous formant un semi-conducteur de type p. La frontière entre ces deux régions, appelé la jonction ap-n, est l’endroit où l’action de la diode a lieu. Lorsque les deux matériaux sont liés ensemble un flux d’électrons se produit à partir du côté n vers p. Comme les électrons circulent il est maintenant une région où aucun des porteurs de charge (électrons et trous dans ce cas) sont présents. Cette région est appelée la région d’appauvrissement. Le cristal permet aux électrons de circuler depuis le côté de type n (appelée la cathode) vers la partie de type p (appelée l’anode) mais pas dans la direction opposée.
Chapitre 8 : Solides – énergie de réseau
Dans les gaz, la capacité thermique est une résultante des mouvements latéraux , de la vibration et de la rotation des atomes.
Dans un solide, il n’y a pas de mouvements latéraux des atomesq ni de rotation. Les atomes peuvent vibrer autour de leur position d’équilibre. La vibration implique une énergie potentielle et une énergie cinétique, chaque terme participant pour ½ R. Comme un solide a 3 dimensions :
Cv=3R
Cependant, cette égalité n’est pas vrai à des températures basses. Elle est liée à la radiation du corps noir. Dans ce cas, la capacité thermique est donnée par :
Un corps noir est un corps idéalisé qui absorbe tout le rayonnement électromagnétique (de toute fréquence). Il émet uniquement un rayonnement appelé rayonnement du corps noir qui dépend de la température seule. Un modèle pour le corps noir est une cavité avec une petite ouverture.
Le rayonnement pénétrant dans la cavité sont piégés à l’intérieur en raison de la géométrie de tis et / ou l’absorption du rayonnement par les parois de la cavité.
A une température fixe et compte tenu de l’équilibre thermique, le trou peut permettre à une partie du rayonnement de fuite à partir du corps noir. Il est le rayonnement du corps noir, et il ne dépend que de la température. En raison de la taille du trou en ce qui concerne le corps, échappant à la radiation a un effet négligeable sur l’équilibre de la radiation à l’intérieur de la cavité.
Le U0 de l’énergie réticulaire ou énergie du réseau est l’énergie du solide à T = 0K. L’énergie du solide à une température donnée est
Nous ne pouvons pas mesurer U0 mais nous pouvons rapprocher sa valeur de l’enthalpie de sublimation: de déterminer l’énergie du solide, nous briser toutes les liaisons pour obtenir le gaz.
Le dernier terme provient de la dilatation du solide dans le gaz. Le volume de la matière solide est négligeable en ce qui concerne le volume du gaz. Si l’on considère un gaz parfait, alors PV = RT. Par conséquent,
Nous pouvons aussi trouver l’énergie réticulaire avec le cycle de Born-Haber a expliqué dans une section précédente.
Pour un solide avec plusieurs éléments, par exemple un solide ionique, le calcul est plus complexe: il existe deux ou plusieurs gaz et interactions électroniques (liaisons ioniques, de répulsion).
Le cycle de Born–Haber :
Les atomes forment des solides car cela conduit à une diminution de leur énergie. Un moyen de quantifier cette stabilisation est le ΔH0Le, l’énergie de réseau, à savoir l’énergie requise pour former un solide à partir des ions gazeux.
Cette énergie est négatif et ne peut être déterminée expérimentalement. La manière habituelle de le déterminer est de construire le cycle de Born-Haber. Ce cycle est construit à partir des transformations de base des constituants, en les prenant séparément et commençant à partir de leurs états normaux. Plusieurs transformations peuvent être envisagées :
– Sublimation: transformation de l’état solide à l’état gazeux
– Vaporisation: transformation d’un liquide en un gaz
– Électroaffinité: l’addition d’un électron à une particule de gaz
– La dissociation: la séparation de deux atomes
– Ionisation: la libération d’un électron à partir d’un substrat
Bâtissons le cycle de Born-Haber de NaCl. Nous voulons déterminer l’enthalpie de cette réaction :
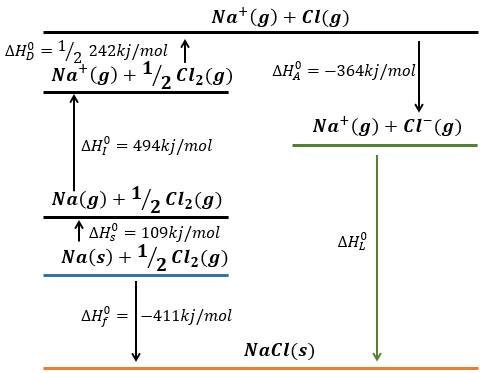
Pour ce faire, nous partons d’une réaction avec une enthalpie connu. Nous savons que l’enthalpie de réaction pour former le solide à partir de Na (s) et Cl (g) est :
La transformation de Na (s) à Na+(g) est réalisée en deux étapes: d’abord la sublimation du solide à un gaz
Et puis l’ionisation du gaz
Il existe deux étapes pour obtenir ainsi Cl–(g) à partir de Cl2(g). La première étape est la dissociation des deux atomes de Cl2. Comme nous avons seulement besoin d’un atome de chlore, l’enthalpie de dissociation est divisé par 2.
La deuxième étape consiste à ajouter un électron à Cl (g) (électroaffinité)
Cette énergie est fortement négative parce que le chlore atteint l’octet. Maintenant, nous avons les deux ions gazeux. Nous avons juste besoin d’additionner l’enthalpie de toutes les étapes pour obtenir l’énergie du réseau. Le cycle de Born-Haber est souvent représenté de cette façon:
Chapitre 7 : Solides – cristallographie
Une caractéristique des solides est qu’ils ont leur propre forme. Les Liquides prennent la forme de leur destinataires et les gaz prennent tout l’espace disponible. Donc les solides ont leur propre forme, mais certains sont malléables, peuvent être coupés, être froissés, brisés ou peuvent être très rigides. Comme expliqué au début de ce chapitre tout est une question d’interactions entre les éléments du solide.
Il ya différents types de structures pour les solides :
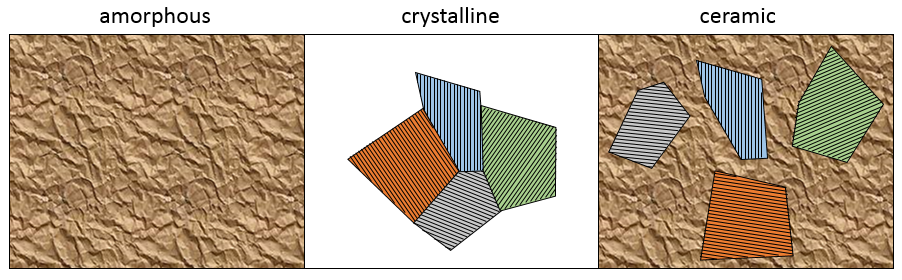
Amorphe : arrangement désordonné des atomes
Crystalline : arrangement ordonné d’atomes. Dans un monocristal, le solide ensemble a augmenté d’un point et il y a un seul arrangement. Cependant il est difficile d’obtenir un monocristal parce que plusieurs points de croissance peuvent développer des cristaux simultanément avec des orientations différentes. Plusieurs cristaux peuvent se développer dans des directions différentes et coexister dans un solide.
Céramique : quelques cristaux dans un réseau amorphe. C’est un mélange des deux types de structure citées plus haut.
La structure d’un solide peut être déterminée par la diffraction des rayons X.
Les solides peuvent être constitués de différents types de liaisons :
Métallique : les électrons peuvent se déplacer le long du solide. Ils sont très compacts et présentent des propriétés identiques dans toutes les directions.
Ionique : les anions sont entourés par des cations et vice versa. Dans le cas des ions sphériques dont les propriétés sont identiques dans les trois directions.
Covalente : les électrons sont localisés entre les noyaux dans les liaisons entre les atomes. Les atomes ne peuvent pas se déplacer librement. Ils sont moins denses que les solides ioniques ou métalliques en raison de la longueur de la liaison et de l’orientation imposée.
Moléculaire : il n’y a aucune règle spécifique à lier. Dans les solides moléculaires, les molécules peuvent se déplacer facilement.
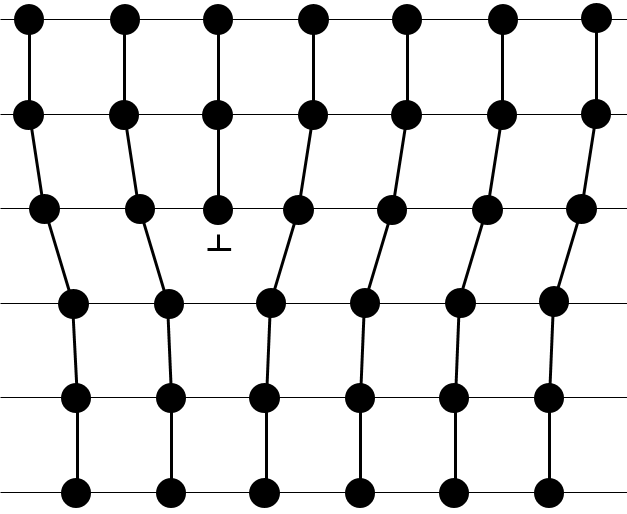
Réseaux cristallins :
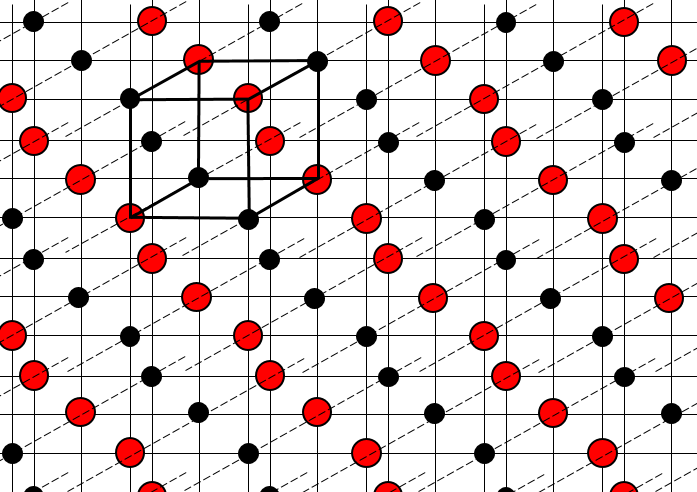
la structure des cristaux peut être définie par le plus petit constituant reproductible du réseau. NaCl est un solide ionique. Chaque Na est entouré par 4 Cl et vice versa. Le plus petit constituant reproductible du réseau est un cube en 4 Na et 4 CL, les atomes se trouvant dans les coins du cube.
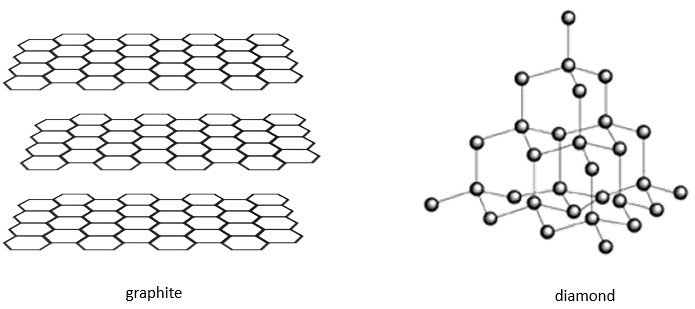
Il existe différentes structures de base pour les solides. En général un composé signifie une structure cristalline. Les cristaux de sel de NaCl ont une structure cubique. Le carbone peut avoir deux structures différentes : le graphite (hexagonales) et le diamant (cubiques face centrée). Dans le graphite il existe des interactions faibles entre les feuilles de carbone ce qui les rend faciles à séparer.
Alors que les atomes sont les mêmes, les propriétés du diamant et du graphite sont très différents. Le diamant ne conduit pas l’électricité, ne se casse pas et est transparent. Leur couleur et leur opacité dépendent des impuretés. La Graphite conduit l’électricité (les électrons de l’orbitale p ne sont pas liés et peuvent se déplacer le long des plans), se brise (les plans peuvent glisser les uns sur les autres) et est opaque.
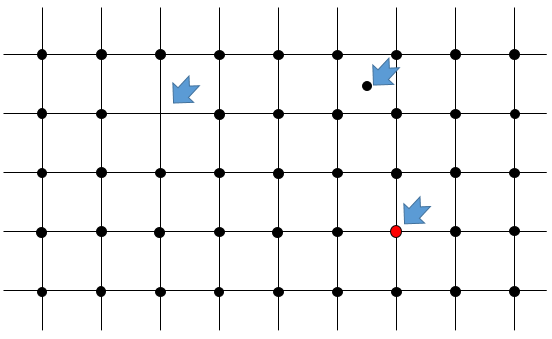
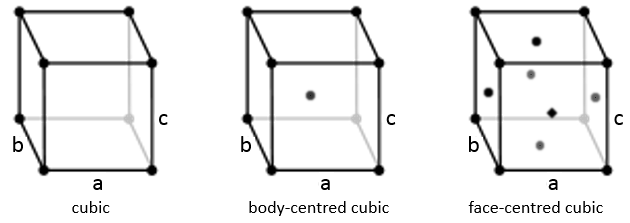
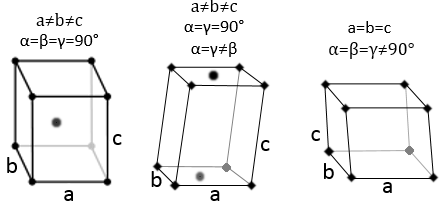
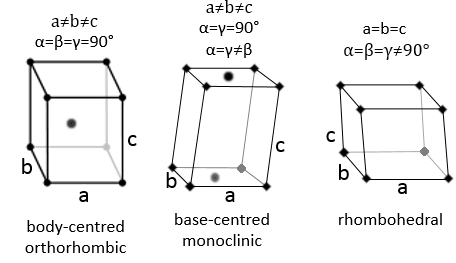
Trois paramètres sont à prendre en considération pour trier les cristaux : les longueurs des côtés (a, b et c) de la structure, les angles entre les côtés (α, β et γ) et la position des atomes dans la structure. Les paramètres géométriques donnent 7 systèmes réticulaires indiqués ci-dessous, tandis que la position des atomes les sub-divisent en 14 réseaux de Bravais
Les différents types de structures sont les suivantes :
Cubique :
Dans la structure cubique les longueurs des côtés sont égales, a = b = c et α = β = γ = 90°. Si un atome est au milieu du cube nous appelons cette structure corps centré. Si un atome est au milieu de chaque face nous l’appelons face centrée.
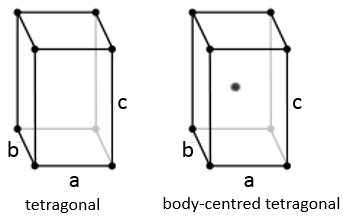
Quadrilatère :
Quand un côté a une longueur différente de celle des deux autres (a=b≠c ), la structure est appélée quadrilatère. Il existe aussi un corps centré pour cette structure.
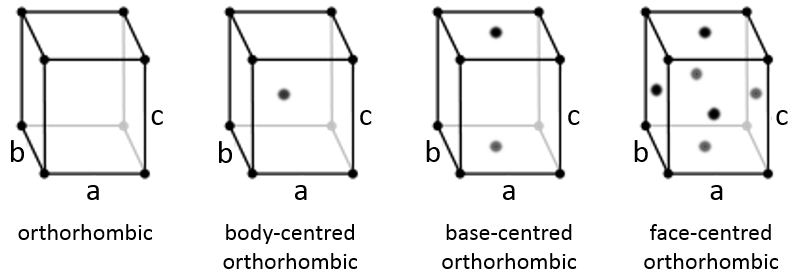
Orthorhombique :
Les angles sont encore de 90 ° mais aucune des trois longueurs caractéristiques n’est égale (a ≠ b ≠ c). Dans le cas de structures orthorhombiques une structure supplémentaire existe : la structure de base centrée. Dans cette structure les deux côtés opposés présentent un atome au niveau de leur centre. Les deux autres côtés ne le font pas.
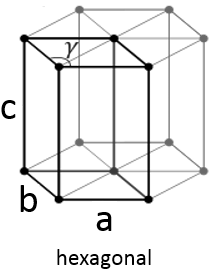
Hexagonal :
Cette structure est appelée hexagonale mais aucune de ses faces n’est hexagonale. Toutefois si vous assemblez trois d’entre eux vous obtenez un prisme hexagonal. La base et la face supérieure sont en forme de losange (a = b) avec un angle γ = 120 °. Les autres faces de la structure sont rectangulaires (a = b≠c) ou carré (a = b = c).
Rhomboédrique :
En ce qui concerne les structures cubiques, a = b = c et les angles sont égaux mais dans une structure rhomboédrique les angles ne sont pas droits : α = β = γ ≠ 90°.
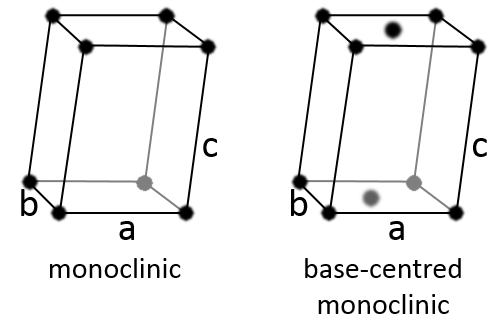
Monoclinique :
Dans ce cas deux angles sont égaux à 90° mais le troisième angle n’est pas droit. Les côtés ont des longueurs différentes a ≠ b ≠ c.
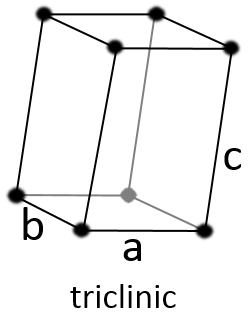
Triclinique :
Les angles α ≠ β ≠ γ ≠ 90° sont différents et il n’y a aucun angle droit. Les longueurs sont également différentes a ≠ b ≠ c.
Compacité (atomic packing factor)
Elle est déterminée par le rapport entre le volume des atomes dans le cristal et le volume total :
Considérant les atomes sphériques une partie du cube est inévitablement vide. Les figures ci-dessus sont schématiques et dans un solide réel les liaisons ne sont pas aussi longues. Nous devrions voir quelque chose comme ceci :
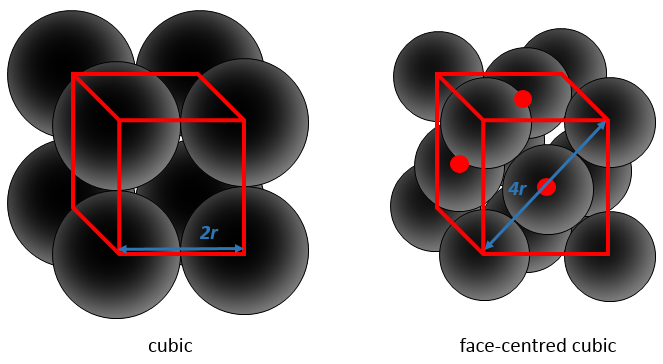
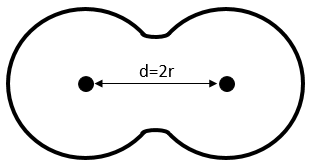
Cette proportion varie d’un solide à l’autre. A titre d’exemple nous allons considérer une structure cubique à faces centrées dans laquelle tous les atomes ont la même taille et le même rayon r. La longueur du cube est un volume et est ainsi h a3.
La longueur de la diagonale est de 4R et à partir du théorème de Pythagore, le carré de l’hypoténuse est égal à la somme des carrés des deux autres côtés d’un triangle. Par conséquent :
Nous savons que le volume total du cube :
Nous avons juste besoin de déterminer combien d’atomes sont dans la structure. Dans chaque coin du cube il y a 1/8 d’un atome. Comme Il existe huit coins alors nous pouvons dire qu’il y a le volume d’un atome au total pour les coins. Au centre des faces il y a la moitié d’un atome. Comme Il y a 6 faces nous pouvons dire qu’il y a 3 atomes supplémentaires, par conséquent il y a 4 atomes dans le cube. Le volume d’un atome est = 3.4 π r3. L’APF, pour cette cubique face centrée, est donc :
Par cette structure particulière, environ un quart du cube est vide. Il en est de même pour la structure hexagonale, il atteint un tiers pour la cubique corps centré et la moitié pour la cubique :
– Hexagonale compacte : 0,74
– Cubique à faces centrées : 0,74
– Cubique à corrps centré : 0,68
– Cubique simple : 0,52
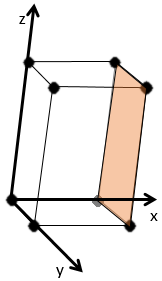
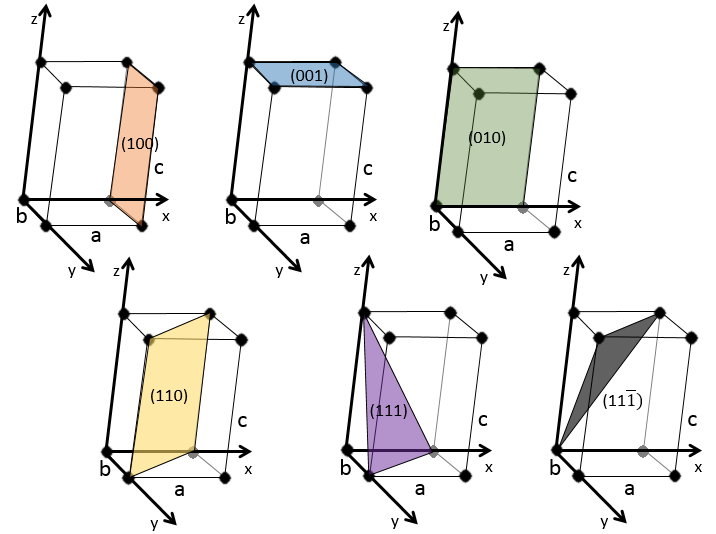
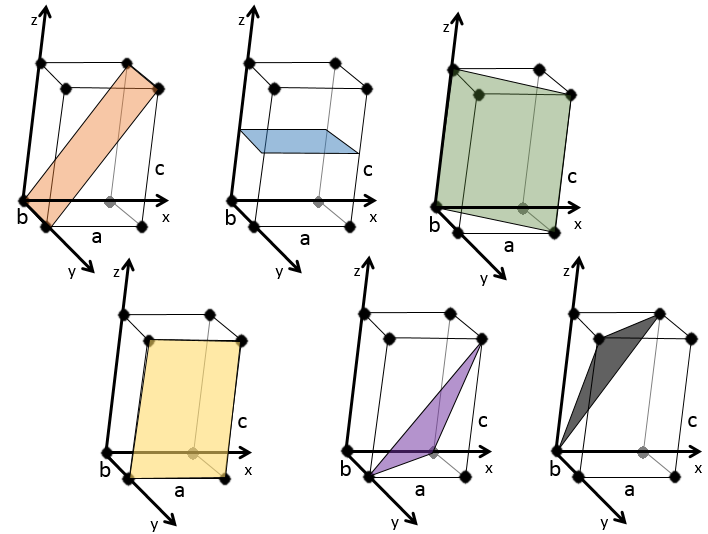
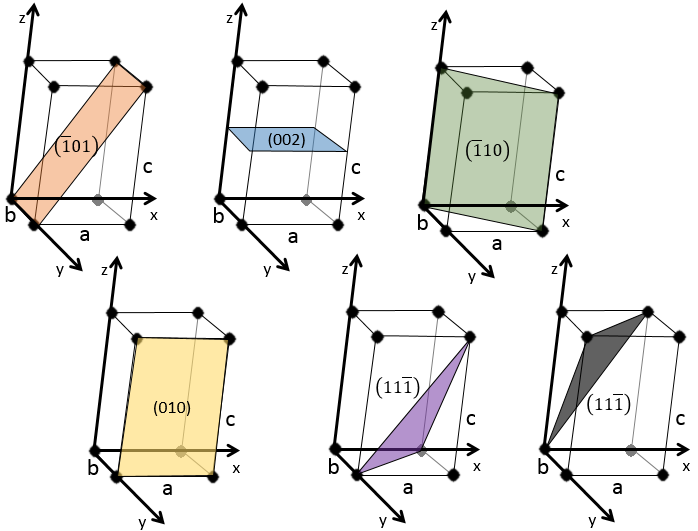
Indices de Miller :
les indices de Miller forment un système de notation pour les plans de réseaux cristallins. Il est principalement utilisé en cristallographie et je ne vais pas le développer intensément ici. Les indices de Miller sont un trio de 3 entiers, écrites (hkl). Considérant un coin d’une structure cristalline, disons une cubique, sous forme de base de notation(000), l’axe suivant les côtés du cristal. Cette base n’est donc pas toujours orthogonale si l’un des angles α, β et γ n’est pas droit. Dans le cas d’une structure cubique la base est orthogonale.
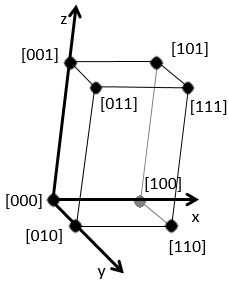
En se déplaçant dans la direction x nous allons trouver un atome après une distance a = 2r. Il est le même si nous nous déplaçons dans les directions y ou z. Pour les indices de Miller, les coordonnées x, y et z sont divisées par les dimensions de la structure a, b et c respectivement :
L’atome sur l’axe des x est à l’emplacement [100] (ce n’est pas un indice de Miller mais plutot une coordonnée). L’atome sur l’axe des y est sur le [010] et l’atome sur l’axe Z est le [001].
Les indices de Miller (hkl) décrivent un plan en disant où il croise l’axe x, y et z. Compte tenu du plan suivant :
nous voyons qu’il est parallèle à l’axe de y et z et qu’il croise l’axe de x à x = 1. Comme le plan est parallèle à Y et Z ils ne se croisent jamais. Nous considérons que ce serait fait à y = ∞ et z = ∞. Pour obtenir les indices de Miller nous prenons 1 sur ces valeurs :
Si les valeurs négatives sont utilisées nous les mettons avec des signes + au lieu de mettre en – un signe moins :
quelques exemples de plans :
Exercices :
1. Comment appelez-vous ces structures ?
2.. Donnez les indices de Miller pour les plans suivants :
Réponses :
1:
2 :
Pour la première, le plan montré passe par l’axe y. Par conséquent nous devons le traduire. Par défaut nous traduisons en suivant l’axe des x par une seule longueur de a à gauche.
Pour la seconde le plan est placé sur le milieu de la structure, à l’horizontale. Rappelez-vous que nous prenons l’inverse de la position : 1/0,5 = 2.
En ce qui concerne 3 le troisième plan passe par un axe. Nous traduisons le plan pour obtenir la bonne réponse.
Les deux derniers plans ont les mêmes indices de Miller. Ils sont parallèles et se confondent si nous appliquons une traduction dans la direction z.
Chapitre 6 : Les Liquides
Les liquides sont un état condensé : le volume d’un liquide ne change pas beaucoup quand une pression est appliquée. Un liquide est un fluide : il n’a pas sa propre forme et les molécules peuvent se déplacer à l’intérieur. Comme dit précédemment les liquides sont caractérisés par un ordre à courte portée et un désordre à longue portée.
Propriétés des liquides :
1) La tension superficielle :
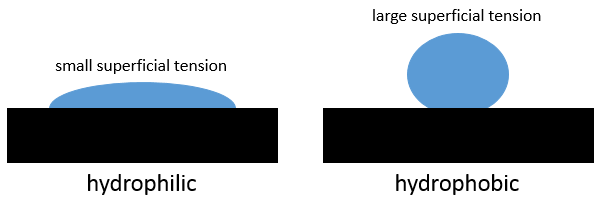
Quand une goutte d’eau tombe sur une surface métallique (par exemple), la gouttelette ne se propage pas complètement. La goutte n’est pas une monocouche de l’eau mais a encore une forme caractéristique et une largeur :
La forme dépend des interactions entre les molécules du liquide, entre elles, et de leur interaction avec les molécules de la surface. Si les interactions avec la surface sont plus fortes que les interactions internes du liquide alors la goutte se propage sur la surface. La surface est dite hydrophile si un liquide se répand sur elle. A l’opposé, sur une surface hydrophobe, les gouttelettes restent dans une forme sphérique (il est possible d’avoir presqu’ une sphère complète). Si la surface est inclinée la gouttelette va simplement rouler sur la surface. Avec une surface inclinée spécialement conçue en forme d’escalier , il est possible pour une gouttelette de grimper sur elle (Enhanced Droplet Contrôle par ébullition de transition, Alex Grounds, Richard Still & Kei Takashina, rapports scientifiques 2, 720)
La tension superficielle est une propriété du liquide tandis que l’hydrophobie est une propriété de la surface.
Pour augmenter la surface (par ΔS), entre un liquide et un solide, un travail W est nécessaire :
γ est donné pour un type de surface de sorte qu’il ne dépend que de l’interaction entre les molécules du liquide. Une petite tension superficielle signifie que le liquide se propage facilement, que le travail pour augmenter sa surface avec le solide est petite. Par exemple l’huile se répand facilement sur une surface. Au contraire le mercure a des liaisons métalliques très fortes et minimise sa surface avec le solide, il garde une forme sphérique.
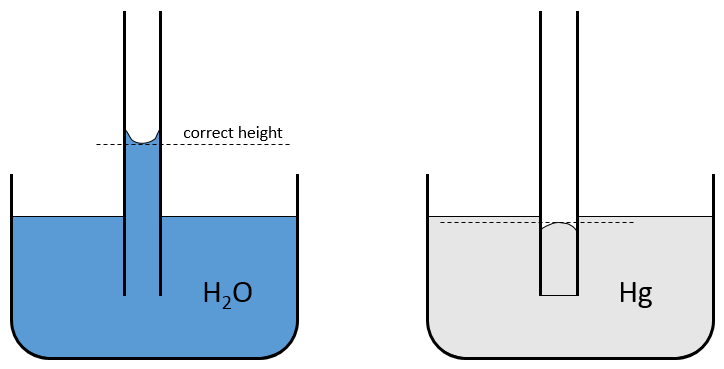
2) La Capillarité :
C’est la capacité d’un liquide à circuler dans les espaces étroits sans forces extérieures ou à l’encontre de forces extérieures. Typiquement, si vous plongez partiellement un morceau de papier dans l’eau, l’eau se déplace vers le haut sur le papier en dépit de l’influence de la gravité. La capillarité est la résultante de plusieurs forces : la force d’adhésion entre le liquide et la surface contre le poids du liquide et la force de cohésion dans le liquide. Sur le papier, l’eau va arrêter de se déplacer vers le haut lorsque les forces s’ annulent entre elles :
Dans un tube de verre la force d’adhésion est importante parce que le verre possède des anions O- qui favorisent l’adhérence. Par conséquent la plupart des liquides inorganiques vont grimper dans un tube, nous pouvons voir que la surface du liquide n’est généralement pas plat mais est plutot incurvée, il est appelé le ménisque. L’énergie d’adhésion est suffisamment favorable pour augmenter légèrement la surface de l’eau-air de sorte que la hauteur le long de la paroi est supérieure par rapport au milieu du tube. La différence de hauteur peut être de plusieurs millimètres. Sur un tube gradué la hauteur à considérer est celle du milieu du tube.
Lorsque la force d’adhésion est inférieure à la force de cohésion, le niveau dans le tube sera plus faible que le niveau du liquide hors de celui-ci, c’est le cas pour le mercure. Son ménisque est également différent de la surface du bain de l’eau comme le mercure évite le contact avec la surface.
Chapitre 5: Les états de la matière: Les Gaz
Les états de la matière:
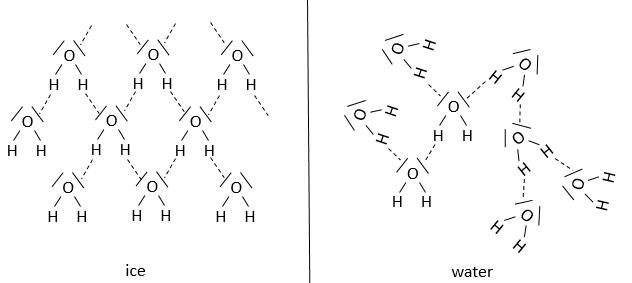
Nous pouvons considérer trois différents états : gaz, liquide et solide et un mélange d’entre eux. Une différence importante entre les trois états de la matière est le volume qu’ils occupent. Un gaz prend tout l’espace disponible, un liquide prend la forme de son récipiant et un solide a sa propre forme. C’est le résultat des interactions entre les molécules qui composent la matière. La composition joue un role mais il n’est pas le seul paramètre à considérer. Simplement défini, la composition de l’eau, de la glace et de la vapeur d’eau est la même (H2O), mais les interactions entre les molécules de H2O sont différentes. Le but de ce chapitre est de décrire les différents états de la matière et les transitions entre eux.
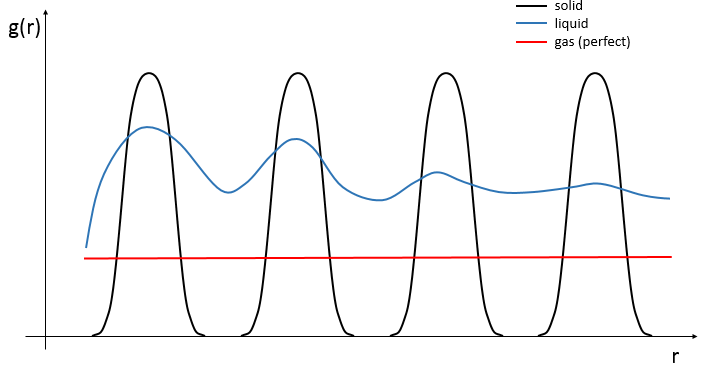
L’agencement de la matière peut être définie à partir de la répartition des atomes de voisinage entre eux. Si nous nous concentrons sur un atome spécifique, la probabilité g (r) de trouver un ou plusieurs atomes à une distance r donnée de l’atome diffère fortement entre les liquides, les solides et les gaz.
Dans un solide les atomes sont organisés et ne se déplacent pas librement (ils peuvent vibrer autour de leur position). La répartition dépend de la géométrie de la matière solide mais elle est caractérisée par des pics élevés localisés à des distances régulières avec g (r) »0 entre eux. Dans un liquide nous pouvons voir qu’il ya encore des couches de voisins autour d’un atome donné mais que l’ordre est moins important. En outre les pics disparaissent après quelques couches. Un liquide est donc caractérisé par un ordre à courte distance et le désordre à longue portée. Le nombre moyen de voisins dans un liquide est en général plus faible que dans un solide. Dans un gaz parfait les atomes ne se subissent pas l’un l’autre et n’ont aucune interaction entre eux. La probabilité de trouver un atome à une distance donnée les uns des autres est donc égale à une distance quelconque. Dans un gaz réel cependant les interactions peuvent exister et g (r) varie légèrement.
Gaz :
Nous sommes entourés par les gaz. Nous pouvons les déplacer quand nous nous dirigeons mais ils appliquent une résistance à nos mouvements. Même lorsque nous ne progressons pas il ya une pression de l’air sur nous. Nous n’y pensons pas parce que nous sommes habitués à cela et notre corps applique une force pour contrer cette pression. Si nous étions soumis à un vide nous irions nous élargir en raison de cette force. Le fait que l’air exerce une pression a été prouvé par Otto Von Guericke (XVIIe siècle). Il construisit deux demi sphères se collant parfaitement pour ne plus en faire qu’une. Il a enlevé l’air à l’intérieur d’elles et a demandé à son seigneur pour essayer de l’ouvrir à l’aide de quatre chevaux. Ils n’ont pas réussi. En remettant de l’air dans la sphère il était, à nouveau, possible de l’ouvrir.
Il ya encore des objets que nous utilisons souvent basés sur ce principe : des ventouses pour la plomberie, celles pour mettre votre GPS sur le pare-brise. Le vide que nous créons n’est jamais complet et la force nécessaire pour retirer une ventouse dépend du degré de vide que nous avons créé. Il devient plus facile de les enlever une fois nous laissons pénétrer un peu d’air dans la ventouse.
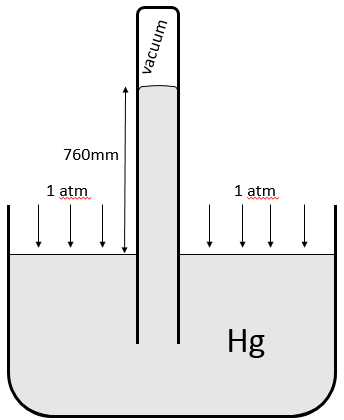
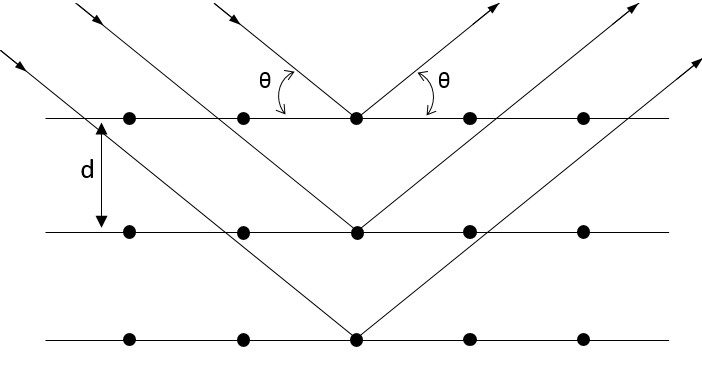
Une pression est une force appliquée sur une surface. La pression exercée par l’air dans des conditions standards est d’une atmosphère ce qui équivaut à 101 325 pascals, le plus souvent donnée en hectopascals (1013 hPa). Nous mesurons également la pression d’un gaz avec torr. 1 atm = 760 torr. L’unité de torr est la hauteur, en mm, qui atteint le mercure dans un tube vide quand une pression est appliquée sur le reste de sa surface dans la disposition ci-dessous:
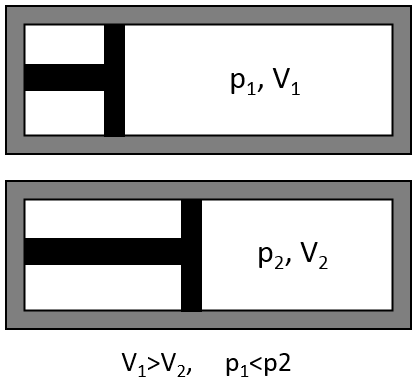
Il existe une relation entre le volume d’un gaz et sa pression. Boyle a déterminé que, à une température constante, la multiplication de la pression d’un gaz par son volume donne une constante.
Si le volume diminue, la pression augmente dans la même proportion :
Charles Gay Lussac observa, d’autre part, que le volume des gaz dépend de la température et que, peu importe le gaz, leur volumes tendent à 0 lorsque la température va vers 0 K (il a étendu les courbes en fonction des changements de d’Etat des gaz).
Un troisième contributeur à la compréhension des gaz est Avogadro qui a indiqué que, à une température et une pression donnée, le volume d’un gaz est proportionnel au nombre d’atomes qu’il contient :
Considérant tout cela la loi des gaz parfaits a été établi :
Cette loi est limitée aux gaz dilués et nous considérons que les particules sont ponctuelles, lointaines et qu’il n’y a pas d’interaction entre eux.
Si l’on considère plusieurs gaz Dalton a montré que la pression totale est donnée par la somme de leurs tensions individuelles.
![]()
En conséquence si l’on considère un mélange de deux gaz :
![]()
La pression d’un composant particulier du gaz est proportionnelle à sa concentration dans le gaz :
![]()
Théorie cinétique des gaz :
On peut mesurer la pression exercée par un gaz sur une surface. Comme expliqué, précédemment, une pression est une force appliquée sur une surface. Une force est une masse multipliée par l’accélération. Une accélération est la variation de vitesse pendant un temps:
A noter que seule la composante de la vitesse perpendiculaire à la surface affecte la pression. Les deux autres composants n’ont pas d’influence sur cette surface particulière :
Nous faisons plusieurs hypothèses sur les particules du gaz :
-Les particules sont de petites tailles et leur volume est négligeable par rapport au volume du gaz. Elles sont considérées comme des points.
-Elles ont toutes la même masse m.
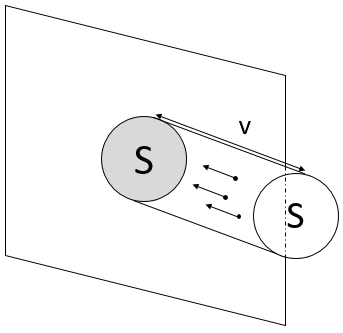
-Elles ont une vitesse constante et vont dans des directions aléatoires. Nous pouvons définir une vitesse moyenne <v>.
-Les particules ne sont pas interagissantes ensemble.
-Toutes les collisions sont purement élastique : il n’y a aucune perte de vitesse ou de l’énergie
Pour déterminer la pression sur une surface S de l’une des parois, on considère que les particules qui sont capables de frapper cette surface dans une période de temps dt. Par conséquent, on ne considère que la particule présente dans un petit cylindre en face de la surface :
Lorsqu’une particule frappe la paroi, il y a une collision élastique et les particules remontent à la même vitesse. Au cours d’une période de temps la vitesse de particules a des changements par rapport à v -v. La force appliquée sur la surface par une particule est ainsi :
![]()
Dans le cylindre, il existe un nombre donné de particules :
N/V est la densité de particules dans le gaz. Parmi celles-ci seulement les particules allant dans la direction x sont importantes pour nous et parmi elles seulement les particules allant dans la direction de la surface (pas dans le sens opposé) induisent une pression sur la surface. Une multiplication par 1/6 est ainsi appliquée pour déterminer le nombre de particules incidentes sur la surface. La pression est donc :
![]()
Dans cette équation, nous reconnaissons l’énergie cinétique Ek=mv2/2. Garder à l’esprit que N = n.NA, on peut écrire :
Par conséquent on voit que l’énergie cinétique des particules dans un gaz est directement proportionnelle à la température :
A partir de là on voit également que la vitesse moyenne des particules est liée à la masse :
Cela signifie que dans un gaz à une température donnée les particules de l’oxygène et de l’azote ne se déplacent pas à la même vitesse. Par exemple : un ballon gonflé à l’azote (N2, M = 28) se dégonfle plus rapidement qu’un ballon rempli d’oxygène (O2, M = 32)
Cette propriété est utilisée pour enrichir l’uranium, à savoir obtenir une plus grande proportion d’un isotope de l’uranium. Compte tenu d’un volume de gaz contenant 235UF6 et 238UF6, une plus grande proportion de 235UF6 passera par un petit écart car il a une vitesse plus grande que238UF6. Ce processus est l’effusion : une séparation sur la base de la vitesse des particules.
La capacité de chaleur (au V = cst) est l’énergie nécessaire pour augmenter la température d’une mole de gaz de 1° est :
La capacité thermique (p = cst) est :
Dans un gaz monoatomique toute l’énergie est utilisée pour augmenter la vitesse des particules.
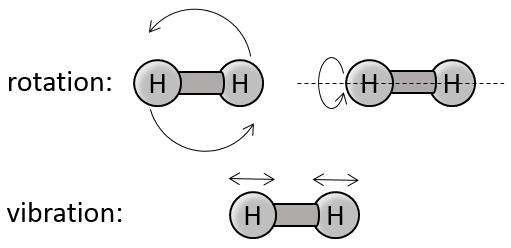
Gaz diatomiques :
Pour des molécules de plus d’un atome l’énergie cinétique est subdivisée en trois directions (1/2R) par direction.
Si un gaz diatomique est chauffé l’énergie est utilisée par plusieurs processus :
1) traduction/accélération: la vitesse/l’énergie cinétique de la molécule augmente.
2) rotation et vibration :
Il existe deux angles de rotation l’énergie nécessaire pour faire tourner est 2 * 1/2R
Si les molécules vibrent elles ont une énergie potentielle. L’énergie obtenue à partir du chauffage est ainsi répartie en énergie cinétique et énergie potentielle. L’énergie requise pour vibrer est donc aussi 2 * 1/2R.
Les valeurs de Cv et Cp sont donc plus élevées que pour un gaz monoatomique :
Donc si nous donnons de l’énergie à Ne et N2, lequel des gaz devrait chauffer plus ? N2 utilise l’énergie de chauffage pour accélérer mais aussi pour vibrer et effectuer une rotation. Ne utilise toute l’énergie comme énergie cinétique et donc chauffera plus que N2.
Répartition de Maxwell-Boltzmann :
Dans les calculs que nous avons fait nous avons supposé que toutes les particules d’un gaz ont été touchées de manière identique par la chaleur. En réalité, la capacité thermique dépend de la température mais tend à 7/2R quand T tend à l’infini. L’explication :
Les particules peuvent avoir différents niveaux de l’énergie cinétique. Lorsque l’énergie est fournie toutes les particules sont également excité. Une proportion de leur population augmente son énergie cinétique d’un niveau (ou plus éventuellement). Au ok (zéro absolu), toutes les particules sont au niveau le plus bas et ne bougent pas. Elles sont congelés.
La population sur le deuxième niveau est donnée par :
ΔE1 est la différence d’énergie entre le niveau 1 et le niveau 0. k = R / NA est la constante de Boltzmann. En général la population est donnée par :
La distribution de la vitesse des particules dans les niveaux d’énergie sont données par la loi de distribution de Maxwell-Boltzmann. A partir de ce qui est dit plus haut on peut ainsi déterminer la variation du niveau en fonction de la vitesse :
Avec A une constante indéterminée nous pouvons écrire cette équation différemment :
Il est possible d’intégrer cette équation sachant que :
Cela signifierait que A=(m/2πkT)1/2. Cependant la vitesse possède trois composants. En conséquence la distribution est :
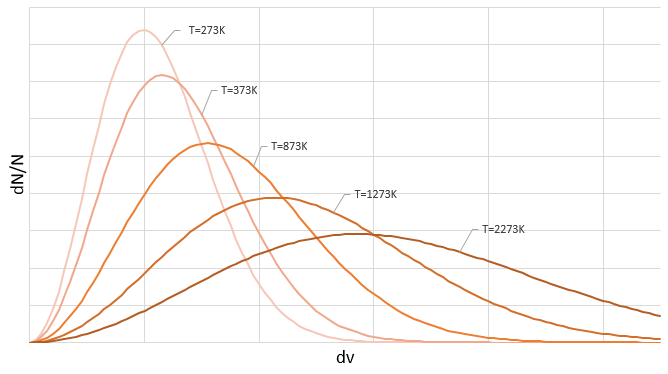
De même pour la probabilité de présence des électrons pour les orbitales électroniques nous intégrons sur une sphère et il faut multiplier cette équation par 4πv2. Nous allons ainsi obtenir la proportion de dN particules sur le nombre total de N particules avec une vitesse donnée dv :
On peut voir sur cette figure que la vitesse moyenne augmente avec la température comme il a été déterminé précédemment dans la relation :
de la loi des gaz parfaits. La vitesse la plus probable se trouve au maximum des courbes quand le DN/N/dv = 0, soit à :
La vitesse moyenne que nous trouvons est un peu plus petite que celle obtenue à partir de la loi des gaz parfaits :
gaz réels :
La loi des gaz parfaits fonctionne bien pour les gaz dilués. Si nous augmentons la pression ou la température des gaz nous voyons des déviations de la loi des gaz parfaits :
Il est parce que le nombre d’interactions entre les particules devient moins négligeable. Les interactions peuvent être attractives ou répulsives mais sont faibles par rapport à l’énergie de liaison par exemple. Les interactions peuvent être entre dipôles induits ou entre dipôles permanents :
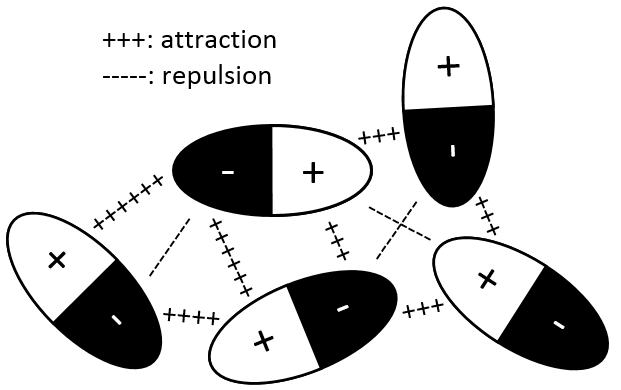
Interaction dipôle permanent- dipôle permanent
Dans ce cas les molécules composant le gaz possèdent déjà un moment dipolaire. Les charges δ + et δ- de molécules qui passent près les unes des autres interagissent : une attraction est induite entre les charges opposées et une répulsion entre les dipôles de même charge :
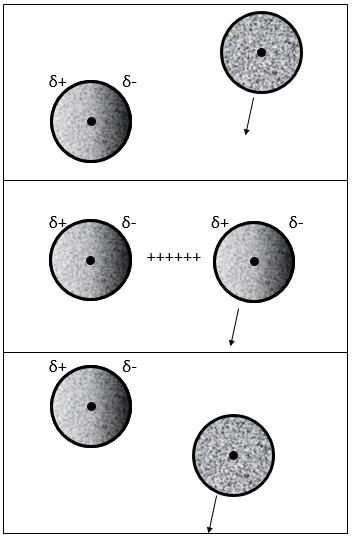
interaction dipôle induit-dipôle induit
Les électrons près d’un noyau sont, statistiquement, également répartis autour du noyau. En d’autres termes le nuage d’électrons est sphérique et la densité d’électrons est identique dans toutes les directions. Cependant les électrons sont constamment en mouvement et les hétérogénéités de la charge peuvent apparaître temporairement. En fait l’apparition de ces dipôles est fréquente mais dans la moyenne leur moment dipolaire est annulé.
Quand un atome passe près d’un autre atome, montrant un dipôle, il adapte son nuage d’électrons envers ce dipôle pour réduire la répulsion entre eux :
En général, les interactions sont favorables entre les particules d’un gaz. Les particules ont tendance à rester à proximité les unes des autres en diminuant la pression à l’égard d’un gaz parfait.
D’autre part les particules ont un volume approprié et les autres particules ne peuvent pas pénétrer dans ce volume. Dans la loi des gaz parfaits les particules ont été considérées comme des points avec un volume négligeable.
Il en résulte que, avec l’augmentation des interactions, la pression augmente plus rapidement que pour un gaz parfait.
Au lieu de la loi de gaz parfait PV = nRT nous devons considérer l’équation de van der Waals pour les gaz réels :
Dans le terme de pression le + a (n / v) 2 exprime les interactions entre les particules. (a) représente la force d’interaction dont la valeur dépend du type d’interaction, la taille des molécules, le nombre d’électrons, etc.. (n/V)2 représente la « densité » des interactions et devrait en fait être n / V * (N-1/V) tel que chaque particule du volume (n) peut interagir avec toutes les autres particules (n-1) mais que le n est proportionnel à NA; la différence est négligeable.
En terme de volume b représente le covolume d’une particule. Le volume vide où les particules peuvent se déplacer est le volume total moins le volume des n particules composant le gaz.
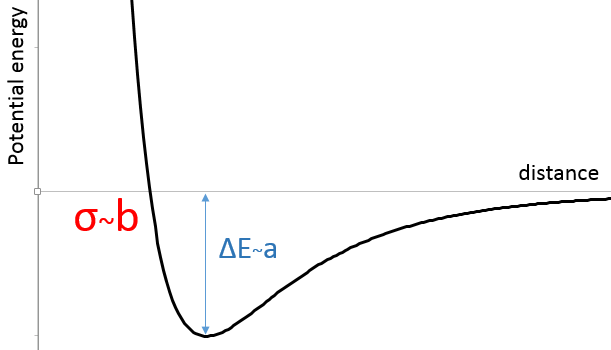
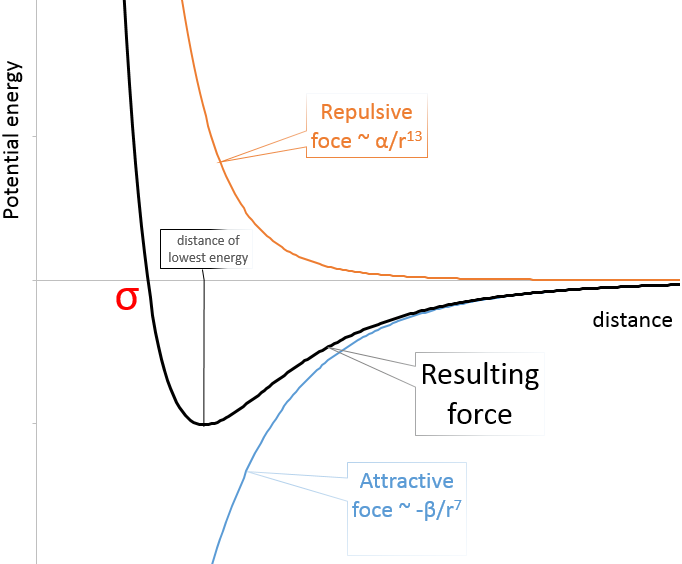
Dans la figure du potentiel de Lenard Jones nous pouvons relier a et b à l’énergie de la fosse et à la distance d’approche plus petite σ :
L’enthalpie de vaporisation ΔHv reflète l’énergie nécessaire pour transformer un liquide en gaz. Il nécessite plus d’énergie pour vaporiser les molécules avec des interactions fortes que de molécules avec dipôles induits seulement. Les sprays d’eau sont vendus à cause de cette propriété : une fois sur notre peau les petites gouttelettes se vaporisent, prennent l’énergie de la peau, diminuant sa température et donnant une sensation de fraîcheur.
Le processus inverse est la liquéfaction. Les molécules de gaz sont distantes les unes des autres. Pour devenir liquide les particules se déplacent dans la fosse de potentiel. Toutefois, si elles ont une trop grande énergie cinétique (dépend de la température), ils vont sortir de l’autre particule. Il faut de l’énergie pour quitter la fosse de potentiel. En conséquence la liquéfaction implique une diminution de la température.
Chapitre 4 : oxydo-réductions
Oxydo-réductions, ou redox, sont des réactions impliquant un transfert de charge entre les molécules. Au cours de ces réactions de l’énergie chimique est transformée en énergie électrique.
Une réaction d’oxydation est une réaction au cours de laquelle un substrat (molécule, atome ou ion) perd des électrons.
Une réaction de réduction est une réaction au cours de laquelle un substrat gagne des électrons.
Un oxydant est un substrat ayant la capacité d’oxyder d’autres substances. Pendant ce processus l’agent d’oxydation est ainsi réduit. Il est aussi appelé oxydant ou agent oxydant.
Un agent réducteur est un substrat ayant la capacité de réduire d’autres substances. Pendant ce processus l’agent réducteur est ainsi oxydé. Il est aussi appelé réducteur ou agent réducteur.
L’état d’oxydation :
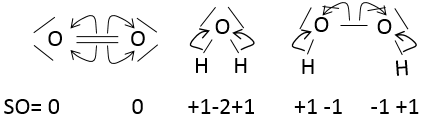
L’état d’oxydation (EO) est un nombre entier dont la valeur est la charge d’un atome si nous brisons toutes ses liaisons. Dans O2, chaque atome reprend ses électrons (c’est un clivage homolytique ou homolyse). La charge globale de O2 est neutre. Ainsi l’ EO de chaque oxygène est égal à 0. Cependant, dans H2O, l’oxygène prend les électrons provenant de l’hydrogène lorsque nous brisons les liaisons parce que l’oxygène est plus électronégatif que l’hydrogène (c’est un clivage hétérolytique ou hétérolyse). L’ EO de l’oxygène dans H2O est -2 et l’ EO de l’hydrogène est de +1 :
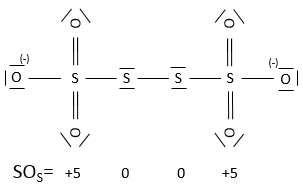
En général le SO de l’oxygène est de -2 et nous pouvons trouver le SO des autres atomes de la molécule sans représentation complète de la molécule. Par exemple, nous pouvons déterminer l’état d’oxydation du manganèse dans MnO4– : la charge globale est -1 et chaque oxygène a un SO de -2. Le SO de Mn est donc 7 de sorte que la charge globale est égale à la somme des états d’oxydation -1 = + 7- (4x-2). Dans l’eau lourde, H2O2, le SO de l’oxygène est -1.
Un atome peut donc avoir plusieurs SO possibles. Si plusieurs SO sont présents pour un atome dans une seule molécule nous prenons la moyenne entre eux. Par exemple S a un SO de 2,5 dans S4O62-. Le soufre peut avoir un SO de 0 (soufre solide) à +6 (H2SO4) :
Les réactions d’oxydoréduction :
Ainsi, dans une réaction d’oxydo-réduction, un oxydant oxyde un agent réducteur tandis que le réducteur réduit l’oxydant. En présence de deux composés il n’est cependant pas toujours évident de déterminer la direction de la réaction :
Cette réaction implique deux demi-réactions :
La réaction ira dans le sens qui a une enthalpie négative. Dans le cas présent, la réaction va de gauche à droite et peut être expliquée parce que le Cu est plus électronégatif que le Zn. Il est donc plus difficile de prendre les électron du Cu que du Zn.
Il est possible de déterminer la force des agents oxydants et réducteurs à partir de leur aptitude à attirer les électrons dans une batterie, à savoir leur potentiel standard ε0 (en volts). Cependant, la valeur absolue du potentiel standard n’est pas mesurée. Nous ne pouvons connaître la valeur de ε0 en ce qui concerne un autre couple. Nous utilisons le couple H+/H2 comme une référence, avec son ensemble potentiel standard ε0=0.000V, dans sctp par convention. Le nom d’un couple est mis dans le sens de la réduction : oxydant/réducteur par exemple : Cu2+/Cu, Zn2+/Zn.
Pour établir correctement une réaction d’oxydo-réduction, un procédé existe :
Premièrement, nous écrivons l’équation supposée sans stoechiométrie, protons, de l’eau ou OH–. Juste les oxydants et les réducteurs. Nous déterminons leur état d’oxydation
Deuxièmement, nous déterminons les potentiels standards individuels de chaque couple. Les valeurs de ε0 peuvent être trouvées pour une large gamme de composés sur le dos du tableau de Mendeleïev. Elles sont données pour les réactions de réduction (pour l’oxydation il faut prendre la valeur négative). Pour le fer, l’éqiuation de la réaction est :
Pour le manganèse 5 électrons sont ajoutés pour obtenir Mn2+
Soyez attentifs pour calculer le nombre d’atomes qui sont réduits/oxydés. Dans le couple Cr2O72-/Cr3+, le Cr a un SO de + 6 → + 3 par conséquent 6 électrons doivent être ajoutés dans la réaction parce que deux Cr sont réduits.
Pour en revenir au problème impliquant le manganèse la réaction n’est pas encore bien équilibrée. L’oxygène est également impliqué dans le processus. Nous équilibrons la réaction avec les molécules d’eau, des protons ou des OH– en fonction de l’acidité de la solution. Pour déterminer combien d’espèces sont nécessaires, nous comptons les charges de chaque côté de la flèche :
Il ya 6 à gauche parce MnO4-est chargé négativement. La différence de huit charges est compensée par l’addition de 8 protons à gauche de la flèche et on équilibre l’équation :
Le potentiel standard de cette réaction est connu. Maintenant nous mettons ensemble les deux demi-réactions. Ne pas oublier de considérer qu’une demi-réaction introduit 5 électrons et l’autre introduit un électron. L’équation de Fe3+/Fe2+ est donc multipliée par 5 :
Cette réaction finale est correctement équilibrée. A noter que même si la demi-réaction Fe3+/Fe2+ est multipliée par 5 elle ne se multiplie pas dans la détermination du potentiel standard. Comme Δε0>0 cela signifie que la réaction va aller de gauche à droite. Cette réaction est spontanée si la production d’enthalpie ΔG0<0. L’enthalpie de réaction est une mesure du travail nécessaire pour faire la réaction. Si cette valeur est négative la réaction est spontanée et libère de l’énergie, généralement sous forme de chaleur. La réaction est alors exothermique. Si cette valeur est positive il est nécessaire de donner un peu d’énergie pour faire la réaction. La réaction est endothermique car il absorbe la chaleur de son environnant.
La relation entre l’enthalpie de la réaction et son potentiel est :
Cette relation vient du fait qu’un potentiel V est la variation de travail J pour modifier la charge Q
Batteries :
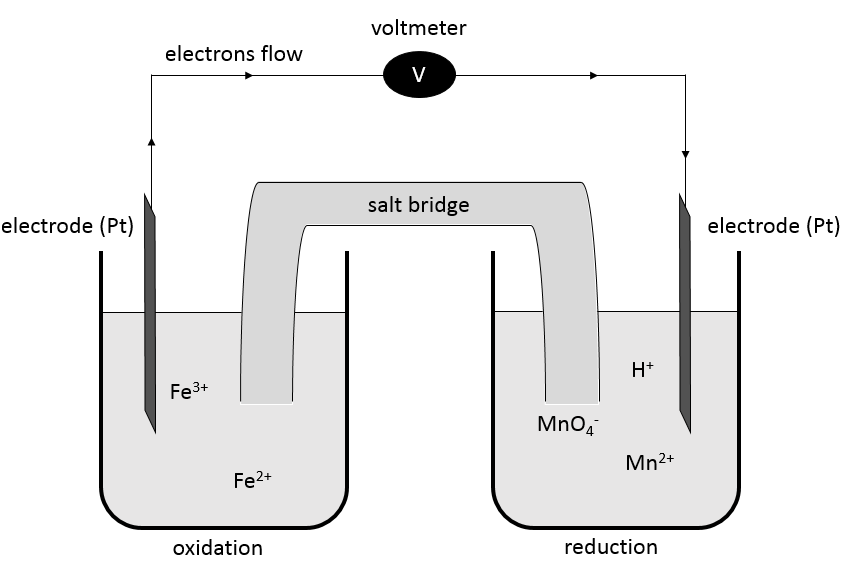
Dans les batteries les éléments d’une réaction redox sont séparés. Les deux solutions sont reliées par un pont de sel et deux électrodes reliées à un voltmètre :
Un pont de sel est un dispositif utilisé pour connecter deux demi-batteries qui sont pleines d’espèces ioniques conductrices de l’électricité (électrolytes) mais sans interférence avec les composés de la batterie. Sans le pont de sel une demi-cellule aurait accumulé des charges négatives et l’autre demi-cellule aurait accumulé des charges positives durant la réaction. Les cations et anions du demi-pont sont choisis de telle sorte qu’ils aient une haute conductivité similaire. KCl, KNO3, NH4Cl sont quelques exemples d’électrolytes qui composent un pont de sel.
Une batterie est écrite, par convention, comme suit :
Les électrodes sont placées aux extrémités et les composés de deux demi- batteries sont séparés par une double ligne symbolisant le pont de sel. L’oxydation est mise en premier et la réduction en second.
L’oxydation de Fe2+ est effectuée à l’électrode de platine qui attire l’électron libéré. Cet électron passe par le voltmètre à l’autre demi-batterie où il est utilisé dans la réduction. Le pont de sel ferme le circuit électrique.
Le potentiel d’une batterie, également appelée force électromotrice, est donné par l’équation Nernst et dépend de la concentration des différentes espèces :
On peut également obtenir le potentiel à partir de la différence entre les deux cellules de la batterie :
Veillez à ce que les concentrations de Fe2+ et Fe3+ soient inversées dans la dernière équation parce que nous considérons les produits et réactifs de demi-batterie dans ce cas.
Dans une pile de concentration la force électromotrice est seulement donnée par les concentrations des espèces :
Les deux côtés de la batterie ont le même ε0 et l’équation de la force électromotrice est donc limité à :
Ici nous ne pouvons pas utiliser KCl comme électrolyte parce que Cl- réagirait avec Ag + pour former un précipité d’AgCl.
Électrodes de référence :
Une électrode de référence est une électrode dont le potentiel est connu et ne varie pas pendant une expérience. L’électrode d’hydrogène standard (SHE) est une première électrode de référence mais n’est pas souvent utilisé car il n’est pas entièrement reproductible :
Le gaz de dihydrogène est introduit dans une solution acide de 1M avec une pression de 1 atm.
L’électrode en chlorure d’argent est utilisé comme électrode de référence :
Le potentiel de l’électrode dépend de la concentration de la forme ionique de Ag.
Cependant, cette concentration dépend aussi de la solubilité dans l’eau de AgCl.
La constante de dissolution de AgCl est KS =[Ag+][Cl–]. En saturant la solution avec du KCl (> 3,6) la concentration de chlorure reste constante d’où la concentration fixe de Ag +.
Le potentiel écrit ci-dessus n’est pas tout à fait exact car, à de fortes concentrations, la concentration n’est plus égale à l’activité d’un ion.
L’électrode au calomel saturé utilise le même principe :
Ici les cations précipitent avec du chlorure de mercure qui est saturé de la même manière que pour l’électrode de chlorure d’argent :
L’inverse de la batterie est une électrolyse : un courant est appliqué à une cellule pour induire une réaction avec une force électromotrice négative. C’est un moyen de déposer des métaux à partir d’une solution :
La quantité de métal déposé est fonction du courant appliqué :
Tous les éléments de la première colonne du tableau de Mendeleïev sont obtenus par électrolyse. Dans la nature ils existent dans leur forme oxydée parce que le monde est oxydant : H2O et O2 sont partout. La production de Na peut être faite à partir de son sel par électrolyse :
Cette réaction est réalisée à haute température (> 600° C) et en absence totale d’eau.
Dismutation :
Dans certains cas une seule espèce joue simultanément le rôle d’oxydant et de réducteur. Une réaction impliquant un tel processus est appelée dismutation. Le sel de cuivre se dissocie dans l’eau en Cu + et Cl-. Cependant le cuivre solide est obtenu au cours du processus, il est une conséquence de la dismutation du cuivre :
Comme la deuxième réaction a un plus grand potentiel la réaction globale forme du cuivre massif :
Le Cu+ dissocié du CuCl forme spontanément Cu2+ et Cu (s).
Le monoxyde de carbone est le résultat de dismutation entre le CO2 et C. C’est souvent responsable de nombreux incidents, parfois mortels, dans une salle de bains avec une ventilation insuffisante. Des traces de carbone obtenues à partir de composés organiques brûlés, réagissent avec le dioxyde de carbone émis par les chaudières ou les appareils de chauffage. Le problème est que le CO prend la place de O2 sur nos cellules sanguines (hémoglobine) et est plus fortement lié à elles que O2 (par un facteur 200). Une fois que le CO est lié à une cellule sanguine, O2 peut avoir beaucoup de difficulté à se lier, par conséquent, à une petite proportion de CO peut être catastrophique. Pour traiter les personnes touchées par le CO, elles sont placées dans une chambre avec une surpression en O2 pour forcer l’équilibre et enlever le monoxyde de carbone.
Le potentiel standard d’une réaction peut être trouvé à partir de ses réactions intermédiaires :
Au total 3 électrons sont nécessaires pour obtenir le fer dans son état solide. Un électron est nécessaire pour la première étape et 2 pour la seconde étape. Le potentiel standard (approximatif) est trouvé par une combinaison du potentiel standard de chaque étape, en prenant, en compte les électrons nécessaires pour chaque étape:
- Au total, le processus a un potentiel standard négatif. La réaction inverse est ainsi spontanée en présence d’un oxydant.C’est la production de stain (Fe3+ hydraté) de fer. Sur une voiture par exemple le fer est protégé par une mince couche de peinture/revêtement, ne permettant pas à l’eau d’aller au contact du fer. Si il y a un défaut sur le revêtement, le fer va être oxydé, mais la tache ne va pas apparaître toujours à cet endroit : les électrons libérés par l’oxydation peuvent se déplacer à travers le métal.
Pour éviter cela les surfaces sont reliées, par un câble électrique, à une pièce de zinc. Le zinc va s’oxyder à la place du fer parce que son potentiel standard est plus petit.
Stain est un matériau poreux et l’oxygène peut le traverser pour aller plus loin. ZnO n’est pas poreux donc une monocouche de Zn peut protéger les pièces de fer de tache. C’est le principe de l’acier inoxydable, mais appliqué avec Cr2O3.
Chapitre 3 : Liaisons et orbitales moléculaires
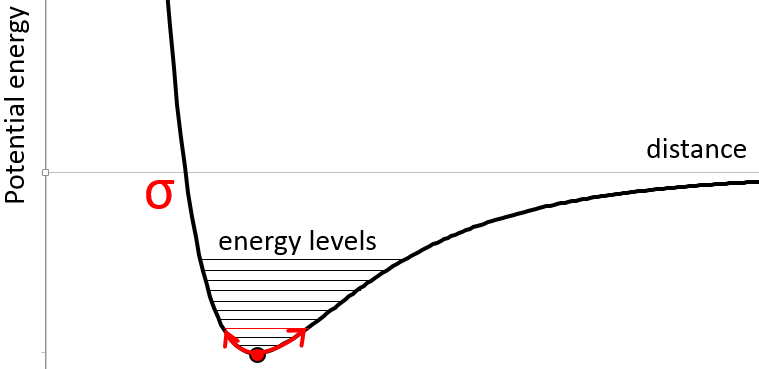
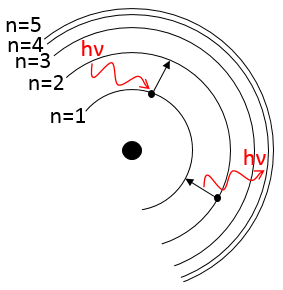
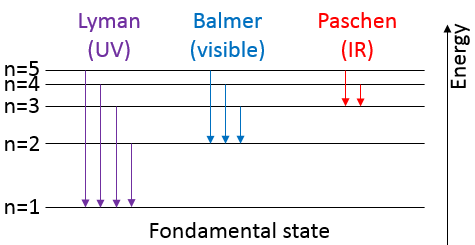
Les atomes font des liaisons parce qu’ils obtiennent plus de stabilité. Une preuve en est que pour briser une liaison nous devons donner de l’énergie à la molécule. Les atomes dans une molécule sont à une distance donnée et oscillent légèrement de cette position en fonction de l’énergie qu’ils reçoivent.
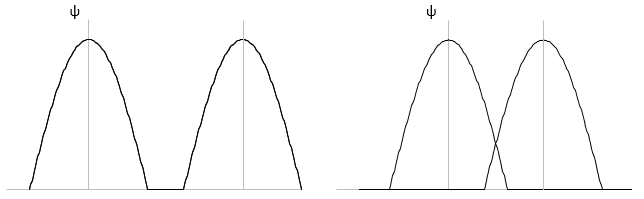
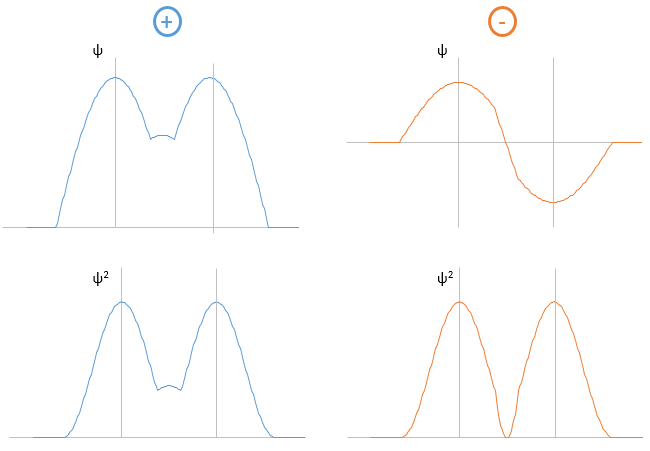
Les atomes ne peuvent pas osciller à une fréquence quelconque. Il y a des niveaux autorisés d’énergie dans lesquels l’atome peut être placé :
Même à n = 0, l’état fondamental, les atomes oscillent à une fréquence donnée.
Il est difficile d’approcher plus les atomes les uns des autres mais il faut aussi de l’énergie pour les éloigner. L’énergie de dissociation est l’énergie nécessaire pour séparer deux atomes à une distance « infini ».
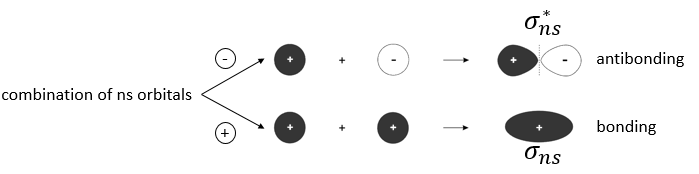
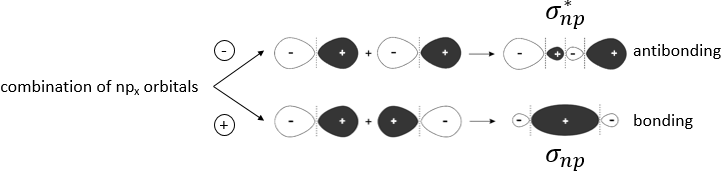
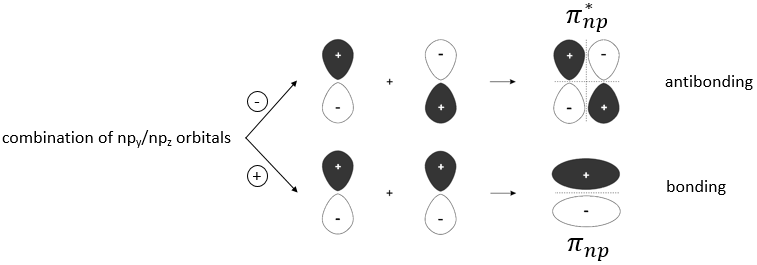
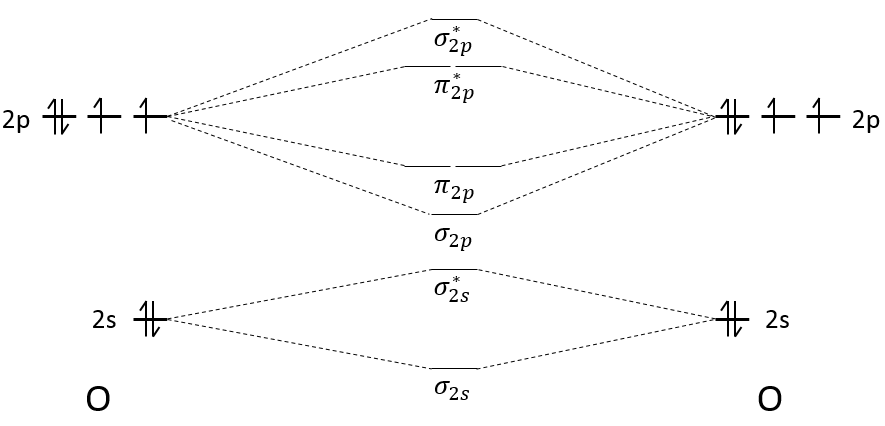
Pour former une liaison, les nuages d’électrons autour des noyaux se concentrent entre les deux noyaux pour protéger leur charge et diminuer la répulsion entre eux. La répartition des électrons diffère selon le type de liaison. Nouvelles orbitales, orbitales moléculaires sont formées à partir des orbitales atomiques pour lier deux atomes :
Seule la dernière couche d’électrons, les électrons de valence, est prise en compte pour les orbitales moléculaires : les couches internes sont trop éloignés pour interagir :
4 types de liaisons existent: covalente, ionique, métallique et liaison coordinative (ou des ponts d’hydrogène). Nous allons développer les deux premiers types de liaison ici :
Liaisons covalentes :
Une telle liaison est faite entre les atomes de même électronégativité (ou presque). Chaque atome met un électron en commun pour faire une liaison covalente. Les électrons dans la liaison sont partagés à parts égales le long de la liaison.
Liaisons ioniques :
Une telle liaison est faite entre les atomes d’électronégativité différente. Dans une liaison ionique les électrons ne sont pas partagés équitablement. L’un est l’atome donneur d’électrons et l’autre est l’accepteur d’électrons. L’accepteur est plus électronégatif que le donneur.
Comme les électrons ne sont pas partagés de manière égale il existe un gradient de la charge le long de la liaison. Nous disons qu’il y a un moment dipolaire.
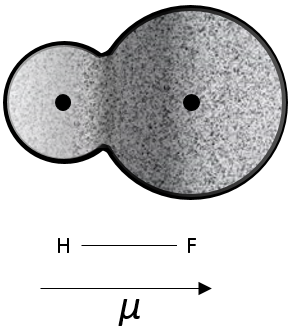
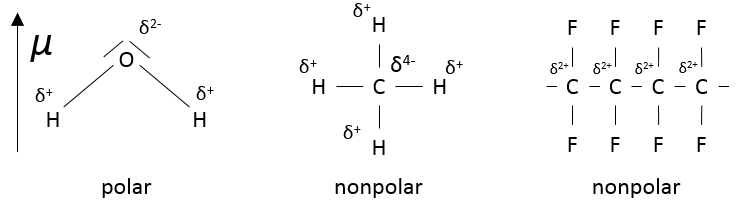
Polarité :
H et F ont des électronégativités différentes (2,1 et 4 respectivement). La plupart des électrons de la liaison sont donc plus proche de l’atome de fluor que de l’atome de l’hydrogène.
Le moment dipolaire mu de cette liaison peut être défini comme
Par définition, le moment dipolaire va de la charge positive à la négative. Si les charges ont été complètement séparées, ce moment devrait être :
D signifie Debye et est égal à 3.336Cm.
La valeur obtenue expérimentalement est 1.83D. Cela signifie que l’hydrogène ne donne pas totalement son électron au fluor. Le caractère ionique de la liaison est donnée par
Et si cette valeur est supérieure à 50%, nous considérons que la liaison est une liaison ionique.
Le fluor a la plus forte électronégativité mais n’a pas une polarité suffisamment importante pour avoir une liaison ionique avec l’hydrogène (41,6% seulement). La raison est que les deux ( H et F) ont un très petit rayon et que la longueur de la liaison est donc faible et la liaison est forte c’est la raison pour laquelle HF est un acide faible tandis que les autres acides halogènes sont des acides forts : la charge négative est plus stabilisé sur Cl-, Br- et I- que sur F-.
Notez qu’une molécule qui a des liaisons polaires n’est pas automatiquement polaire, CH4 est non polaire. Le polyfluorocarbone (CF2)n est aussi non polaire :
Les molécules polaires sont solubles dans des solvants polaires et les molécules non polaires sont solubles dans les solvants non polaires. Sur les vestes les molécules non polaires sont greffées pour que la pluie ne pénètre pas la veste mais puisse rouler sur elle. Sur une surface non polaire, l’eau ne se propage pas mais restreint sa surface au minimum, formant ainsi une sphère.
Règle de l’octet et la charge formelle :
Grâce à la liaison les atomes essayent d’avoir 8 électrons de valence la configuration électronique des gaz nobles. Par exemple CaCl n’est pas une molécule correcte. Ca a 2 électrons de valence et Cl en a 7. Pour lier Ca donne un électron à Cl. Cl atteint l’octet mais Ca a toujours un électron de valence à perdre. La formule correcte est CaCl2 : Ca donne un électron à chacun des deux Cl pour atteindre la structure électronique d’Argon (gaz noble).
Dans CO2 , les liaisons sont covalentes et les électrons sont partagés entre C et O. CO2 pourrait avoir deux structures :
On peut voir que les oxygènes de la molécule de la gauche ne sont pas équivalentes. Dans une molécule la distribution électronique doit être la plus homogène possible. Chaque atome a une charge formelle (FC)
Analisons le FC de chaque atome :

Dans la molécule de la droite les atomes n’ont pas de charges formelles et cette molécule est donc plus stable que la molécule de la gauche où des charges sont séparées. En fait la première molécule est une forme de résonance (à savoir une structure ayant la même composition mais une répartition électronique différente) mais moins stables que la deuxième molécule:
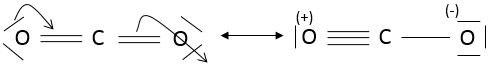
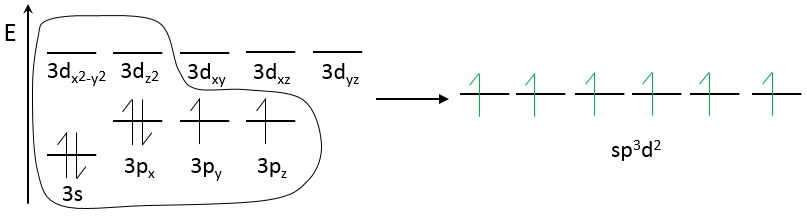
La règle de l’octet fonctionne très bien pour les trois premières lignes du tableau de Mendeleïev. Après cela certaines orbitales nd vides peuvent être utilisées pour lier les atomes. Par exemple S peut se lier à 6 atomes de fluor (SF6).
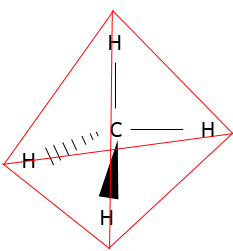
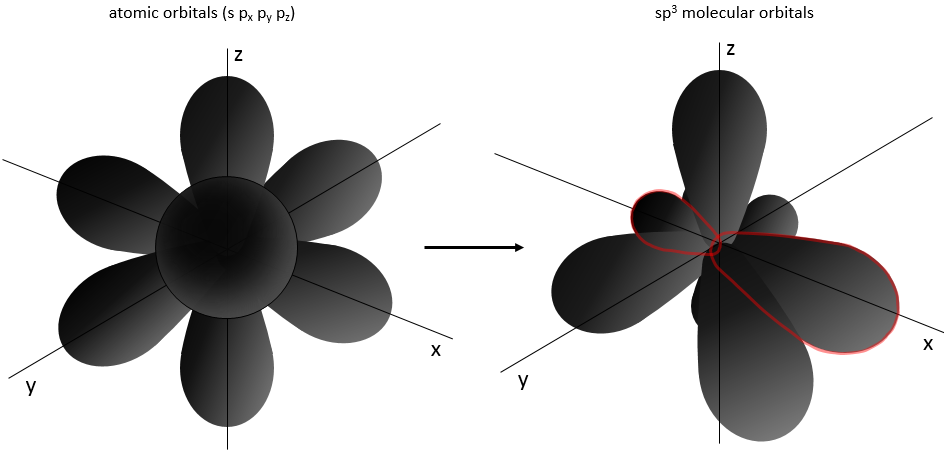
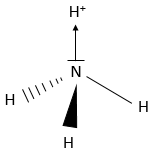
Maintenant est-ce que cette molécule est vraiment linéaire (comme nous l’écrivons)? Pour déterminer la structure spatiale d’une molécule nous devons considérer les orbitales atomiques de chaque atome et le fait que les liaisons sont répulsives entre elles (parce qu’elles sont chargées négativement). CO2 est donc linéaire ayant un angle de 180° entre les deux doubles liaisons pour réduire la répulsion entre elles. CH4 est un tétraèdre régulier, ayant un angle de 109° entre chaque liaison:
Le triangle noir est une liaison allant dans le sens du lecteur et les tirets représentent une liaison allant dans la direction opposée.
Les doublets libres prennent également l’espace dans une molécule. En fait ils prennent plus de place que la liaison normale : les électrons sont entassés près de l’atome. En conséquence H2O n’est pas linéaire mais est un tétraèdre. Cependant elle n’est pas un tétraèdre régulier car l’angle entre les paires libres (> 109°) est supérieure à la dist ance entre les liaisons (<109 °). NH3 est aussi tétraédrique , mais il a la particularité spécifique d’osciller rapidement entre les deux formes équivalentes :
Hybridation :
Nous avons vu plus tôt les formes d’orbitales atomiques (OA) et aucunes d’entre elles n’étaient tétraédriques. Les orbitales atomiques se mélangent pour former de nouvelles orbitales moléculaires (OM) qui sont utilisées pour se lier avec d’autres atomes, c’est le processus d’hybridation.
Une des orbitales moléculaires est indiquée en rouge pour plus de commodité. Ces orbitales hybrides sont le résultat de l’hybridation des orbitales atomiques s et p. Les orbitales ns et np ont des énergies différentes et se fondent dans les orbitales moléculaires sp d’énergies égales. Seule la dernière couche des orbitales (avec des exceptions) fusionne pour former un nouvel ensemble d’orbitales. Les orbitales intérieures ne sont pas modifiées comme indiqué pour le NH3 :
N dispose de 5 électrons de valence : 2 dans 2s et 3 dans 2p. Ils se fondent dans 4 orbitales sp3 d’énergie égale. L’exposant 3 sur p indique que 3 orbitales p ont été fusionnées avec une (pas indiqué comme exposant) orbitale s. Comme d’habitude les électrons sont placés sur toutes les orbitales avant d’être appariés. Une orbitale contient 2 électrons appariés déjà: il est la paire appariée. Les trois autres orbitales sp3 contienent 1 électron chacunes. L’hydrogène va apporter un électron supplémentaire sur ces orbitales pour se lier et former NH3.
Nous pouvons faire la même chose pour H2O :
L’oxygène a un électron de plus que l’azote, il en résulte une seconde paire jumelée et seulement 2 liaisons d’hydrogène à O.
Pour SF6 deux orbitales 3d vides sont utilisés :
Quatre des six liaisons sont dans le même plan et les deux autres sont de chaque côté de ce plan. SF6 a donc une structure octaédrique.
les orbitales de liaison et d’antiliaison :
quand deux atomes se rapprochent les uns des autres leurs orbitales atomiques ultrapériphériques interagissent pour former des orbitales moléculaires. Nous avons vu précédemment les orbitales de liaison mais il n’ est pas la seule combinaison possible des orbitales qui peuvent avoir lieu. La combinaison peut être soit positive ou négative.
Li2 combine les orbitales 2s de chaque atome. Les combinaisons positives et négatives des fonctions d’onde donnent :
Si nous mettons cela à la puissance 2 nous obtenons la probabilité de présence des électrons. Dans le cas de la combinaison négative on peut voir qu’ entre les atomes il ya un point où la probabilité de trouver des électrons est nulle. Elle conduit à une orbitale antiliante. Dans le cas de la combinaison positive la probabilité de trouver des électrons entre les atomes est élevée partout. Elle conduit à une orbitale liante. Les orbitales liantes sont stables et conduisent à une liaison persistante. Les orbitales antiliantes sont instables et les liaisons ne sont pas faites. On note ces orbitales avec une *. Les orbitales moléculaires résultant des orbitales ns sont appelées sigma σ:
Le même genre de liaison et orbitales antiliantes existent pour les orbitales np, nd et nf. Les orbitales np dans le sens de la liaison forment un orbital sigma et les autres orbitales np sont responsables des liaisons doubles et triples et sont appelés liaisons pi :
Les orbitales moléculaires ont des énergies différentes et nous allons maintenant expliquer comment déterminer quelles orbitales sont utilisées et quelles autres ne le sont pas.
Les orbitales atomiques des deux atomes sont placées sur la gauche et sur la droite. Sur le milieu nous plaçons les orbitales moléculaires qui résultent des orbitales atomiques :
Chaque orbitale donne une orbitale moléculaire liante et une antiliante. Les orbitales moléculaires sont placées de bas en haut en allant de la moins énergique à la plus énergique. Pour Z <8, leMO π2p et σ2p sont inversés : la MO σ*1s et σ2s repoussent l’un contre l’autre. Pour déterminer l’énergie d’une orbitale moléculaire nous utilisons la combinaison linéaire des orbitales atomiques (LCAO). Cette méthode sera vue dans les cours de la deuxième ou troisième année. Cependant, comme il est une combinaison linéaire, l’énergie moyenne de l’orbitale moléculaire obtenu à partir d’orbitales atomiques est égal à l’énergie moyenne de ces orbitales atomiques. Par exemple l’énergie des orbitales moléculaires σ2s+ σ*2s est égale à l’énergie des orbitales atomiques 2s + 2s. C’est également le cas lorsque les orbitales atomiques ne possèdent pas la même énergie :
La deuxième étape consiste à distribuer les électrons sur la MO. Les électrons sont répartis de bas en haut et chaque orbitale moléculaire accepte deux électrons appariés.
L’effet de la construction de ces orbitales moléculaires est que l’énergie des électrons a été réduit : seulement deux électrons ont une énergie supérieure à celle des orbitales 2p mais les 6 autres ont une plus petite énergie (sans compter les électrons des orbitales 2s). L’ordre de la liaison donne une bonne idée de la force de la liaison et est donné par :
L’ordre nous dit que la liaison entre les deux oxygènes est une double liaison. Lorsque l’ordre de liaison est grande cela signifie que la liaison est énergique et courte.
Magnétisme :
le magnétisme est la réaction d’une particule à un champ magnétique. En réaction à un champ magnétique une particule s’oriente contre le champ magnétique ou dans sa direction. Ce comportement dépend principalement de la structure électronique de la particule et de la température :
Diamagnetisme :
diamagnetisme est l’opposition de toute particule à un champ magnétique. Il apparaît dans tous les matériaux mais est très faible en ce qui concerne d’autres comportements magnétiques. En conséquence il est seulement visible dans les matériaux purement diamagnétiques. Pour cela un matériau diamagnétique a tous ses électrons appariés. Les spins opposés d’électrons appariés annulent le moment magnétique électronique intrinsèque : les électrons sont des espèces chargées tournant dans un sens (spin) autour du noyau et peuvent interagir avec un champ magnétique externe.
Des électrons non appariés alignés avec un champ magnétique orientent les particules dans la même direction que le champ magnétique. Toutefois, lorsque le champ extérieur est retiré, les particules ne conservent pas les propriétés magnétiques.
Ferromagnetism :
c’est la plus forte réaction à un champ magnétique et est la propriété des aimants. Quant au paramagnétisme les électrons non appariés alignent avec un champ magnétique mais il existe un effet supplémentaire pour les particules ferromagnétiques : les particules adjacentes alignées présentent une interaction magnétique dipôle-dipôle. Sous certaines conditions les orbitales de leurs électrons non appariés peuvent se chevaucher. En conséquence un effet similaire à l’exclusion de Pauli s’applique: il réduit l’énergie électrostatique des électrons quand leurs spins sont parallèles et non anti-parallèles. La différence d’énergie entre l’état parallèle et l’état anti-parallèle est appelée l’énergie d’échange et définit la force du ferromagnétisme d’une particule.
Couleur :
la couleur des composés vient directement de la différence d’énergie entre l’orbitale moléculaire (= HOMO) occupée la plus élevée et celle située juste au dessus (= BV, l’orbitale moléculaire inoccupée la plus basse). La molécule absorbe la lumière pour exciter un électron. Pour passer d’un niveau le photon doit avoir la même énergie que la différence d’énergie entre les niveaux. Cela signifie que seule la lumière d’une couleur donnée est absorbée. Parce que cette couleur est absorbée, nous ne la voyons pas mais nous voyons les couleurs qui ne sont pas absorbées par la molécule.
La fluorescence est la lumière émise lorsqu’un électron excité est dé-excité à un niveau intermédiaire à la place de son niveau fondamental. La couleur émise est donc différente de celle absorbée et le processus est très lent.
Liaisons métalliques :
dans un métal tous les atomes sont liés entre eux. Les orbitales moléculaires se fondent dans une bande de continuum de conduction. De ce fait les électrons sont partagés par tous les atomes dans le métal et peuvent se déplacer le long des électons du métal, c’est pourquoi les métaux conduisent l’électricité.
Liaisons coordinatives :
les liaisons coordinatives sont des liaisons faites quand un atome portant une (ou plusieurs) seule paire d’électrons utilise une paire pour se lier à un cation.
Les deux électrons d’une liaison coordinative proviennent à la fois d’un atome. La géométrie de la molécule ne change pas quand une liaison coordinative est faite et la liaison doit être à la position initiale de la paire libre.
Dans les liaisons hydrogène le cation est un proton. Ces liaisons sont plus faibles que la liaison covalente normale mais peuvent avoir un rôle important dans la structure d’un composé :
Par exemple, la différence entre la glace et l’eau est la proportion et la disposition des liaisons hydrogènes. En effet les liaisons hydrogène travaillent en synergie pour renforcer la structure. Il existe une restriction de l’angle entre la liaison hydrogène et l’autre liaison hydrogène, qui dépend du composé. La présence et l’absence de liaison hydrogène a une grande responsabilité dans la structure et donc l’efficacité des protéines.
Le cation peut également être un métal de transition. Dans ce cas la molécule de liaison est appelée un ligand. Le ligand ciblera les orbitales nd vides du métal. La géométrie du composé résultant est tétraédrique ou octaédrique selon les orbitales moléculaires générées.
Les orbitales atomiques nd se divisent à deux niveaux d’énergie différents. Les orbitales d’énergie plus faible sont dxy, dxz et dyz pour la structure octaédrique et les orbitales dx2-y2 et dz2 ont une énergie plus élevée. C’est le contraire pour les structures tétraédriques.
La chimie de coordination est un domaine complexe de la chimie et il sera discuté en détail dans les cours de la deuxième année.
Chapitre 2 : tableau périodique des éléments
Le tableau de Mendeleiev est aussi appelé la classification périodique des éléments. Plus qu’une simple liste des atomes existants, Mendeleïev a trié les éléments en fonction de leur oxydation / réduction par O / H
R20 R0 R302 RH4 RH3 RH2 RH R
Le R est l’élément. Les atomes du même niveau d’oxydation ont été triées en fonction de leur poids pour obtenir les différentes lignes. Certains trous étaient présents dans le tableau mais on a supposé que les éléments manquants ne sont pas encore découverts. Les scientifiques ont été en mesure de remplir le tableau périodique par la synthèse artificielle de ces éléments. Dans le tableau montré, ci-dessus, les éléments 110 à 118 sont théoriques.
On ne l’imaginait peut être pas au départ mais la détermination de ce tableau était une énorme amélioration pour les chimistes. Le tableau contient un nombre gigantesque d’informations pour chaque atome mais montre aussi certaines tendances périodiques.
Un cas :
Il y a un grand nombre de modèles différents pour les tables périodiques. Certains d’entre eux ne montrent que le symbole, le nom, le numéro atomique (Z) et le poids de chaque élément, mais de nombreuses autres informations peuvent être affichées pour chaque élément. Voici un exemple pour l’aluminium.
Son symbole est Al, son numéro atomique est 13 et il a un poids de 26,981538 unités de masse atomique (ce qui équivaut à la masse molaire en g/mol). Le poids est la propriété que nous cherchons la plupart du temps sur un tableau de Mendeleïev. Le nombre d’électrons pour chaque couche peut être déterminé à partir de Z mais est souvent indiqué dans le tableau périodique. Aluminium Z = 13 ce qui signifie que la couche n = 1 est complète avec deux électrons, la couche n = 2 est complète avec 8 électrons (2 sur 2s2 et 6 sur 2p6)
et que les trois électrons doivent être distribués dans la couche n = 3. Les deux premiers électrons sont dans 3s2 et le dernier électron est dans une orbitale 2p. De cela nous pouvons déterminer que Al est sur la troisième ligne du tableau (n = 3) dans la troisième colonne (3 électrons sont dans la dernière couche). L’aluminium a un état d’oxydation unique (EO) de +3 (à voir dans une section suivante). Les éléments après la troisième colonne peuvent avoir plusieurs EO en fonction de la façon dont ils utilisent leurs électrons. Enfin, certaines températures sont indiquées pour nous faire savoir dans quel état, solide, liquide ou gazeux, l’élément se trouve à une température donnée.
lignes :
Chaque ligne correspond à une valeur de n. Étant donné qu’une couche d’électrons est ajoutée pour chaque ligne le rayon des éléments augmente quand on descend dans le tableau périodique. Le nombre d’éléments dans une ligne n’est pas identique d’une ligne à l’autre parce que les orbitales p et d ne sont pas présents dans les premières lignes. On peut également voir deux lignes particulières au bas du tableau les lanthanides et les actinides correspondant aux éléments possédant une orbitale nf extérieure.
Colonnes:
Les éléments sur une même colonne ont le même nombre d’électrons de valence. Chaque colonne est appelée une famille et a un nom particulier. Les trois premières colonnes et les 5 dernièrse sont désignées Ia, IIa, IIIa, …, VIIIa et contiennent les principaux éléments. Entre les deux sont situés les métaux de transition notés Ib, IIb, …
Ia (sauf H) : les métaux alcalins : ils sont tous brillants (mais ternissent au contact de l’air), mous, très réactifs (dans les conditions standards de température et de pression) et perdent facilement leurs électrons ultrapériphérique pour former un cation. Ils forment les bases fortes lorsqu’ils sont liés à OH- (NaOH, KOH).
IIa : métaux alcalino-terreux : ils sont tous brillants et réactifs (en sctp). Ils perdent facilement leurs électrons ultrapériphériques pour former un cation de la charge 2+.
IIIa : icosagens ou triels : la colonne de bore et d’aluminium. Ils ont 3 électrons dans leur couche externe. L’aluminium est un des métaux rares à avoir une faible densité.
IVa : crystallogens ou tetrels : le groupe du carbone et du silicium. Ils ont 4 électrons de valence. Le carbone est le composant essentiel des corps vivants (~ 23% d’un être humain) mais il est aussi un constituant de la terre par les carbonates, et de l’atmosphère par du CO2. Il est très résistant à la chaleur. Le silicium est un constituant majeur de la terre le deuxième en abondance. Si et C sont dans la même colonne mais sont étonnamment différents. Une de leurs propriétés communes c’est qu’ils peuvent faire de longues chaînes (C cependant peut faire des chaînes beaucoup plus longues que Si ). C peut former des liaisons pi tandis que Si ne peut pas parce que son rayon est trop grand ( la superposition des orbitales est impossible). CO2 est un gaz tandis que SiO2 est un solide (quartz) qui est la base des matériaux en verre.
Va : pnictogens : le groupe de l’azote et du phosphore. Ils ont 5 électrons de valence, dont deux jumelés. Ils forment des liaisons covalentes stables et peuvent former des liaisons doubles et triples. Cette aptitude à former des liaisons persistantes est la source de la toxicité de certains éléments de ce groupe (arsenic, antimoine). D’autre part N2 est un gaz inerte qui représente 78% de l’air.
VIa : halcogènes : le groupe de l’oxygène et du soufre. L’oxygène a des propriétés très différentes de celles du reste de ce groupe : les éléments de ce groupe sont doux et ne conduisent pas bien la chaleur. L’oxygène constitue 21% de l’atmosphère, 46% de la croûte terrestre en poids et 65% du corps humain. L’oxygène se produit également dans de nombreux minéraux, étant trouvé dans tous les minéraux d’oxyde et d’hydroxyde minéraux, et dans de nombreux autres minéraux. L’ozone est formé spontanément dans la haute atmosphère où il attrape les rayons UV du soleil
Le radical émis va réagir immédiatement avec une molécule voisine. L’ozone est un meilleur oxydant que O2 car une liaison pi est délocalisée. En conséquence l’ozone est souvent utilisé pour tuer les bactéries sans gaspillage.
VIIa : Halogènes : Tous les halogènes forment des acides lorsqu’ils sont liés à un atome d’hydrogène et sont généralement toxiques. Ils forment également des sels quand ils font des liaisons avec des produits alcalins.
VIIIa : gaz noble/gaz Rare: ces éléments sont inertes, ils ne réagissent avec aucun autre élément. L’hélium est l’élément le plus commun dans l’univers (~ 24% de sa masse). En raison de leur manque de réactivité on les utilise dans l’éclairage (également vrai pour l’azote)
Les métaux, non-métaux, métalloïdes :
Le tableau périodique peut être divisé en trois grandes sections : métaux, non-métaux, métalloïdes. Ces trois catégories sont bien regroupées dans le tableau (sauf H comme toujours). La plupart des éléments sont des métaux. Les non-métaux sont sur le coin supérieur droit du tableau (+ H) et les métalloïdes sont des éléments situés sur une diagonale allant de Bore au Polonium.
Métaux :
Les métaux ont une bonne conductivité thermique et électrique. Comme une vaste catégorie ils ont des propriétés communes mais des exceptions existent pour plusieurs d’entr’ eux (pour une ou plusieurs propriétés).
Ils ont en général une énergie d’ionisation faible, une faible électronégativité et, quand ils font des liaisons, ils donnent ou partagent leurs électrons. La liaison de deux ou plusieurs métaux forme un alliage. La plupart d’entre eux peuvent former des oxydes et se trouvent naturellement dans cet état.
En général ils sont solides mous et malléables de haute densité mais certains sont des liquides dans les conditions naturelles (Hg par exemple). La plupart d’entre eux sont de couleur argentée.
Non-métaux :
La plupart des non-métaux sont des gaz de faible densité dans les conditions naturelles. Quand ils font des liaisons ils partagent ou acceptent des électrons et ne font pas d’oxydes basiques (mais ils forment des oxydes acides comme HClO, H2SO4, etc). En opposition au métaux ils ne conduisent pas l’électricité, la chaleur et ils ont une énergie d’ionisation et électronégativité élevée. Habituellement dans la nature ils ne se trouvent pas dans un état combiné.
Métalloïdes :
Ils sont la minorité des éléments. Ils ressemblent à des solides métalliques et peuvent former des oxydes (acide, base ou amphotères). La plupart sont des semi-conducteurs et des conducteurs thermiques modérés, et ont des structures qui sont plus ouvertes que ceux de la plupart des métaux.
Propriétés périodiques :
Rayon atomique:
plusieurs types de rayons peuvent être déterminés pour un seul élément.
Rayon cristallin : un cristal est un solide dans lequel les atomes sont disposés dans l’espace. Les monocristaux sont obtenus à partir de l’agrégation des atomes sur un atome unique. Ils ont l’avantage d’avoir moins de défauts dans la structure que des cristaux disposés autour de plusieurs sources. Les cristaux ne sont pas nécessairement constitués à partir d’un seul élément, on peut par exemple, faire des cristaux de protéines afin de déterminer leur structure spatiale.
Le procédé pour obtenir des cristaux est le suivant : l’élément du cristal est d’abord dissout dans un solvant, la dissolution peut être aidée par une augmentation de la température. Une fois la dissolution terminée, le but est de diminuer très lentement l’affinité de l’élément avec le solvant. Il peut être fait par l’évaporation du solvant (un autre solvant de faible affinité remplace le solvant évaporé) ou si la solution est chauffée, par une lente diminution de la température. Le processus doit être lent pour éviter la formation de plusieurs centres d’agrégation.
La structure des cristaux et la distance entre les atomes dans un cristal dépendent de ses éléments constitutifs et peut être déterminée par diffraction au RX.
Dans ce procédé un faisceau de RX frappe la surface d’un cristal avec un angle θ donné :
L’interaction de ce faisceau avec les atomes des premières couches du cristal. Cette interaction donne lieu à la diffraction seulement si :
Où d est la distance entre les couches dans le cristal, θ l’angle d’incidence et la longueur d’onde λ du faisceau. Cette équation est l’équation de Bragg. Si ces conditions ne sont pas remplies l’interaction entre les atomes et le faisseau est destructif (c-à-d qu’ils s’annulent) et la diffraction ne se produit pas. Le rayon est la moitié de la distance entre les atomes dans le cristal.
Rayon Calculé : on considère ici que le rayon pour lequel la probabilité de présence de l’électron est le plus grand est le rayon de l’atome.
Rayon de Van der Waals : Le rayon de Van der Waals est obtenu par l’addition de la force répulsive et la force attractive entre deux atomes. Ces deux forces dépendent de la distance séparant les atomes mais pas de la même façon. L’attraction est proportionnelle au rayon à la puissance -7 tandis que la répulsion l’est à la puissance -13. En conséquence il existe une distance favorable entre les atomes quand ils se lient. Il est la fosse d’attraction. Réduire cette distance augmente considérablement l’énergie potentielle. σ est la distance favorable la plus petite et est à l’intersection entre la courbe et Epot = 0. L’augmentation de la distance augmente également l’énergie potentielle vers 0.
Le rayon de l’atome peut être déterminée à partir de σ.
Rayon covalent : pour les molécules diatomiques le rayon de l’atome est considéré comme la moitié de la longueur de la liaison.
Rayon empirique : il est obtenu à partir du volume du gaz atomique. Dans un volume donné de gaz il existe un nombre donné d’atomes. Considérant les atomes sphériques le volume d’un atome est V=4/3π r3. Par conséquent le rayon est déterminé.
Ces différents rayons ne sont pas égaux et dans certains cas ils n’existent pas. Par exemple, il n’existe pas de rayon covalent pour He. Toutefois chacuns d’eux suivent la même répartition logique dans la table périodique :
Comme nous l’avons vu dans la section précédente une couche d’électrons est ajouté à chaque nouvelle ligne du tableau périodique. Il est donc logique que le rayon des éléments augmente dans une seule colonne. Se déplaçant à travers une ligne le nombre de protons dans le noyau augmente et les électrons externes sont ainsi de plus en plus attirés par le noyau. De gauche à droite le rayon diminue. En conséquence Li et Mg ont un rayon similaire, de même que Na et Ca.
L’énergie d’ionisation :
l’énergie d’ionisation (IE) est l’énergie nécessaire pour enlever un électron d’un atome d’un gaz :
Cette énergie est positive (les atomes dans le gaz ne perdent pas leurs électrons spontanément) et dépend de l’énergie de l’électron : un électron proche du noyau est plus difficile à enlever. Il est également beaucoup plus difficile à retirer un deuxième électron d’un atome qui en a déjà perdu un. Par exemple l’aluminium a des énergies d’ionisation suivantes :
Le premier électron est relativement facile à enlever : c’ est le seul électron sur l’orbitale 3p de l’aluminium. L’électron suivant est beaucoup plus difficile à enlever : c’est un électron sur une orbitale complète. La troisième énergie d’ionisation est petite, pour une troisième ionisation : on obtient la structure électronique du néon gazeux noble : l’octet est terminée et cette structure est stabilisée. Cette stabilisation est visible dans la prochaine énergie d’ionisation : une énergie gigantesque est nécessaire pour enlever un électron supplémentaire.
Les énergies de l’ionisation sont périodiques sur le tableau de Mendeleïev. Il nécessite une énergie massive pour arracher un électron à partir d’un gaz noble mais il est plus facile d’aller vers sa structure électronique. Dans une période/ligne on peut voir que la tendance de l’IE n’est pas linéaire. Il est plus difficile que la moyenne pour enlever un électron d’une orbitale complète.
Il est plus facile d’enlever un électron apparié (moins de répulsion).
Il est plus facile de vider l’orbitale : le dernier électron est protégé par les électrons des orbitales intérieures.
Pour la même dernière raison l’IE diminue lors du déplacement vers le bas dans le tableau périodique : l’effet de blindage est plus grand et plus grand avec le nombre de couches d’électrons.
Electroaffinité :
l’ électroaffinité est tout le contraire de l’ionisation : il est l’énergie requise par un atome gazeux à accepter un électron supplémentaire et suivre l’évolution opposée à la IE.
A noter que les gaz rares ne possèdent pas d’électroaffinité car ils sont inertes.
Electronégativité :
l’électronégativité est une notion importante dans la chimie : c’est la capacité d’un atome à attirer les électrons d’une liaison qu’elle partage. Le symbole de l’électronégativité est χ.
Pauling a déterminé que, par convention, le fluor(ayant la plus grande électronégativité) a un χ = 4. Les autres éléments ont une électronégativité donnée par :
Où DXY est l’énergie de dissociation entre X et Y soit l’énergie nécessaire pour rompre une liaison entre X et Y.
Le fluor est dans le coin en haut à droite du tableau il est difficile de comprendre la tendance pour l’électronégativité.
Chapitre 1 : Structure électronique des atomes
Reprenons ce que nous savons des atomes : les atomes peuvent être décomposés et sont composés d’espèces chargées(protons etélectrons) et de particules neutres(les neutrons). Les atomes sont différents pour chaque élément (ou isotope) par le nombre de ces trois espèces. Un noyau est au centre de l’atome et est entouré de vide et d’un nuage d’électrons. Le noyau est constitué de neutrons et de protons et fait la majeure partie de la masse de l’atome. Toutefois la distribution spatiale des électrons est non aléatoire. Plusieurs théories planétaires orbitales ont été proposées après les travaux de Rutherford sur le noyau atomique mais il est le modèle de Bohr qui peut être considéré comme le premier modèle viable. Certaines des hypothèses de ce modèle ne sont pas correctes, mais il a été la première étape vers la compréhension de la structure de l’atome.
Bohr a travaillé sur l’émission de lumière à partir de dihydrogène H2. Dans un environnement électrique H2 se dissocie en 2 H* excités qui émettent de la lumière avant de retourner à leur état (niveau) fondamental.
hv est la façon habituelle de représenter un photon, émis ou absorbé lors d’un processus physique ou chimique. h=6.626×10−34Js est la constante de Planck. La lumière émise a seulement quelques longueurs d’onde sélectionnées.
Basé sur ce fait, il a élaboré un modèle pour la structure électronique de l’atome. Malheureusement le modèle ne fonctionne que pour l’hydrogène et le cation de He, c-à-d des atomes avec un électron unique.
Bohr a utilisé 4 postulats :
1- les électrons tournent sur des orbitales circulaires
2- sur une orbitale donnée, un électron ne doit pas perdre de l’énergie
3- les gains ou les pertes d’énergie correspondent au saut d’un orbital à l’autre.
4- les électrons sont soumis à un moment angulaire L
Bohr a calculé le rayon et l’énergie des orbitales : pour rester sur une orbitale circulaire donnée l’électron subit une force centrifuge (partie gauche de l’équation) qui est contrebalancée par l’attraction du noyau (partie droite)
où ε0 est la permittivité du milieu. Comme MVR = NH, nous pouvons simplifier les équations comme ce-ci :
En introduisant la force centrifuge dans l’équation précédente, nous obtenons une expression pour le rayon d’un électron :
L’énergie d’un électron est la somme de son énergie cinétique et de son énergie potentielle. L’énergie potentielle vient directement de la force de Coulomb (rappelez-vous que l’énergie est une force multipliée par la distance)
Le rayon a été déterminé précédemment et peut être utilisé pour déterminer l’énergie d’un électron d’un atome donné :
R est la constante de Rydberg et R=-2.178 10-18J.
Pour passer à une orbitale du plus grand nombre/rayon, un électron nécessite une quantité d’énergie donnée, obtenue à partir de la chaleur ou de la lumière, ce faisant l’électron est dit excité.
Pour revenir à son état fondamental l’électron excité libère la même énergie sous la forme d’une lumière d’une longueur d’onde donnée. La longueur d’onde de la lumière est directement liée à la différence d’énergie entre les orbitales :
Ce genre de transition à partir d’un niveau excité à la fondamentale est appelé une transition de Lyman et émet dans les longueurs d’onde UV. Si le niveau de destination n’est pas le niveau fondamental, d’autres noms sont donnés :
La deuxième hypothèse de Bohr était incorrecte et les électrons interagissent ensemble.
Pour déterminer la bonne forme de l’orbitale et la position des électrons il est d’abord nécessaire de développer la mécanique quantique.
Mécanique quantique
Un principe important de la mécanique quantique est le principe d’incertitude de Heisenberg : il est impossible de déterminer à la fois la position exacte et le mouvement exact d’une particule comme un électron ou un photon :
Cette relation signifie que nous pouvons travailler avec probabilité pour estimer la position d’un électron. L’électron n’est pas considéré comme un point mais comme une onde stationnaire le long de son orbite.
La vague a un nombre donné n ( (1, 2, 3, …) des points fixes, à savoir les points où l’onde croise la position théorique de l’électron sur son orbitale. Il est plus facile d’expliquer cela sur une trajectoire linéaire mais il fonctionne aussi bien sur une orbitale circulaire. Ce nombre n sera utile plus tard.
Pour déterminer(la probabilité de) la position d’un électron nous devons résoudre l’équation de Schrödinger
Ĥ est l’opérateur hamiltonien et Ψ est la fonction d’onde à déterminer. Pour résoudre cette équation nous utilisons la particule dans la méthode de la boîte : imaginez une boîte carrée de longueur L contenant une particule, la probabilité de trouver la particule en un lieu donné peut être déterminée. Dans notre cas la particule est un électron et le noyau se trouve dans le centre de la boîte.
Ainsi, la relation à résoudre est :
Le fait que la seconde dérivée de la fonction donne la fonction elle-même implique que celle-ci doit être sinus ou cosinus. Le fait qu’elle est négative indique qu’elle doit être une fonction sinus. Nous allons essayer une solution du type :
A et k seront déterminés plus tard mais ne dépendent pas de x. Nous pouvons maintenant facilement confirmer notre hypothèse précédente :
Comme A ne dépend pas de x, il peut être supprimé sur le dérivé sans problème et de simplifier l’autre côté de l’équation :
Nous donne une relation pour E :
Les valeurs de k et de A seront désormais déterminées à partir des conditions des frontières de la boîte :
– L’électron n’est pas sur les frontières :
– L’électron est dans les frontières de la boîte. Sa probabilité de présence Ψ2
De la première relation nous trouvons la valeur de k :
Compte tenu de cela la deuxième relation donne la valeur de A :
L’intégrale du sinus est égale à 1, par conséquant la valeur de A est simplement
La fonction d’onde est donc :
La probabilité de trouver un électron à un endroit donné est Ψ2 (x) :
En conséquence pour n = 1, la probabilité de trouver un électron est le plus grand au centre de la boîte, à savoir près du noyau. Pour n = 2 il ya un point fixe au centre de la boîte, ce qui signifie que la probabilité d’être près du noyau est nulle.
Cependant le volume près du noyau est très limité et ce paramètre doit être pris en compte. Nous utilisons donc une probabilité de présence radiale : Ψ2(x)4πr2 pour obtenir la distribution des électrons.
Selon n la probabilité de la position d’un électron peut donc varier. Pour une augmentation de n la distance des électrons augmente mais deviennent de plus en plus près les uns des autres (rappelez-vous les chiffres du modèle de Bohr).
Nous n’allons pas développer beaucoup plus la mécanique quantique dans cette section. Une autre notion est toutefois nécessaire pour déterminer le nombre d’électrons dans les orbitales différentes : les nombres quantiques.
Nombres quantiques
Il ya 4 nombres quantiques (NQ)
1- NQ principal : n=1, 2, 3,… ce nombre définit la taille et l’énergie de l’orbitale.
2- NQ de moment angulaire : l. L va de 0 à n-1. En fonction de la valeur de l, les orbitales sont nommées s, p, d ou f. Les formes de ces orbitales sont différentes
- Orbital s
- Orbital p
Les orbitales p sont axiales
- Orbital d
Les orbitales d sont essentiallement biaxiales. Deux sont sur les axes et les 3 autres sontà 45° entre les axes.
- Orbital f
Les Orbitales f sont polyaxiales (nous n’allons pas les dessiner ici)
3- NQ magnétique : ml
ml passe de -l à l et définit l’orientation de l’orbitale
4- NQ du spin : ms
ms définit le spin des électrons. Les électrons peuvent aller dans deux directions opposées et ms = -½ ou ½.
Les électrons doivent avoir un ensemble différent de NQ : c’est le principe de l’exclusion de Pauli. Cela signifie qu’une orbitale ne peut accepter qu’un nombre donné d’électrons. On peut donc seulement avoir deux électrons de spins opposés pour un ensemble de trois autres NQ. Lorsque les deux électrons sont ensemble on dit qu’ ils sont jumelés.
Par exemple il peut y avoir 8 électrons pour n = 2 : l peut avoir une valeur de 0 ou 1
Pour l = 0 l’orbitale correspondant est l’orbitale 2s. ml = 0 et ms peut être soit ½ ou -½. Il ya donc deux électrons de spins opposés dans l’orbitale 2s.
Pour l = 1, l’orbitale correspondante est 2p. Trois valeurs de ml sont possibles (allant de -l à l) : ml = -1, ml= 0 et ml= 1 (correspondant aux trois directions cartésiennes x, y et z). Chacune de celles-ci peut accepter un électron du spin ½ et -½. L’orbitale 2p peut donc posséder 6 électrons.
Au total, 8 électrons peuvent être placés pour n = 2
Si n = 3, 10 électrons supplémentaires peuvent être placés dans l’orbitale d pour un total de 18.
Toutes les orbitales ne possèdent pas la même énergie et les électrons vont d’abord prendre place dans les orbitales d’énergie plus faible. En effet les électrons externes sont sur orbitales plus énergiques : les couches intérieures d’électrons ont un effet de blindage sur la charge du noyau et ont également un effet de répulsion sur les électrons externes.
L’énergie de l’orbitale dépend de n :
E (n = 1) <E (n = 2) <….
Mais aussi de l
Ens<Enp<End<Enf
Toutefois le classement global est plus compliqué que seulement toutes les orbitales de n = 1, puis n = 2, etc …
Il existe une méthode pour se rappeler l’ordre dans lequel nous plaçons les électrons sur les orbitales :
Les électrons sont placés suivant les flèches. 2 électrons peuvent être placés sur orbitales ns, 6 sur orbitales np, 10 sur orbitales nd et 14 sur orbitales nf. Ce numéro est indiqué sur la figure en haut à droite pour chaque ensemble (n, l) de l’orbitale. Deux électrons sont d’abord placés sur l’orbitale ls chacune avec un spin différent. On fait de même dans l’orbitale 2s. Il faut moins d’énergie pour placer deux électrons appariés sur l’orbitale ls que l’un dans l’orbitale 1s et un dans l’orbitale 2s . Cependant dans un même ensemble de (N, L), il faut moins d’énergie pour placer un électron sur chaque orbitale. Donc il ya trois orbitales dans le 2p : 2px, 2py et 2pz. Un électron est ainsi placé sur chacun de ces trois orbitales puis les électrons sont jumelés.
Il y a quelques exceptions à cette méthode en raison de la stabilité notamment des orbitales d. Les orbitales d sont les orbitales externes des atomes métalliques de transition, elles sont très stables quand elles sont complètes ou demi-complètes, c.à.d quand elles ont 10 ou 5 électrons. Les électrons des orbitales inférieures peuvent être déplacés dans les orbitales d pour atteindre ce quota. Jetons un coup d’oeil sur certains métaux afin de mieux comprendre ce phénomène.
La configuration électronique de V (Z = 23) est :
[Ar] 4s2 3d3
On n’a pas besoin d’écrire la configuration complète d’atomes. Les électrons internes ne disposent pas d’incidence sur les propriétés de l’atome. Au lieu de cela, nous écrivons le nom du gaz noble précédent entre accolades. Argon (Ar) a Z = 18 donc il y a encore 5 électrons à placer sur les orbitales. Les 2 premiers électrons sont jumelés sur les 4s et les trois autres sont placés sur 3 orbitales 3d. Même si 4s dispose d’un plus grand n, il est moins énergique que 3d en raison d’un effet de pénétration (développer). Il n’ y a rien de particulier dans ce cas.
La configuration électronique de Cr (Z = 24) qui a plus d’électrons que V est :
[Ar] 4s1 3d5
Un électron a été pris à partir des orbitales 4s pour atteindre le demi achèvement des orbitales d. Pour Z = 25 (Manganèse, Mn), l’orbitale 4s reçoit l’électron supplémentaire. Le même phénomène se produit pour le cuivre Cu (Z = 29) pour obtenir une orbitale complète 3d :
Ni: [Ar] 4s2 3d8
Cu: [Ar] 4s1 3d10
Sur la table périodique de Mendeleïev une ligne commence lorsque nous plaçons un premier électron dans une orbitale ns. Cependant, ce n’ est pas de cette façon que le tableau a été élaboré initialement. Nous allons examiner de près ce tableau dans le chapitre suivant, expliquant sa forme, les éléments et les propriétés générales qui peuvent être directement liées à la place de l’élément dans le tableau.